Kryštalická štruktúra tuhých látok, vlastnosti, typy, príklady

- 4111
- 629
- Denis Škriniar
Ten kryštalická tuhá látka Sú to tí, ktorých mikroskopické štruktúry sú usporiadané a dodržiavajú výrazný vzor pre určitú kryštalickú sieť; Napríklad: Cubic, šesťuholník, triklinický, rhomboédrica,.
Hovorí sa, že tieto pevné látky existujú ako kryštály, ktoré ukazujú aspekty a geometrické vzory, ktoré odrážajú, ako sú objednané vo vnútri. Ďalšími príkladmi kryštalických tuhých látok sú diamant, kremeň, antraén, suchý ľad, chlorid draselného alebo oxid horečnatý.
 Kryštalická tyčinka zločinu. Zdroj: Pixabay.
Kryštalická tyčinka zločinu. Zdroj: Pixabay. Dvojica vysoko známych kryštalických tuhých látok je cukrom a soľou (NaCl). Na prvý pohľad nosia oba biele kryštály; Ale jeho vlastnosti sa veľmi líšia. Cukor je molekulárna kryštalická tuhá látka, zatiaľ čo soľ je iónová kryštalická tuhá látka. Prvý sa skladá z molekúl sacharózy; A druhý, z i iónov+ a cl-.
Horný obrázok vám umožňuje nahliadnuť do toho, ako môžu byť kryštály jasného cukru. Soľné kryštály, ale nie sú pozadu. Aj keď cukor a soľ vyzerajú ako bratia, ich štruktúry sú rôzne: cukor, ktorý sa stáva sacharózou, má monoklinickú štruktúru; Zatiaľ čo soľ, kubická štruktúra.
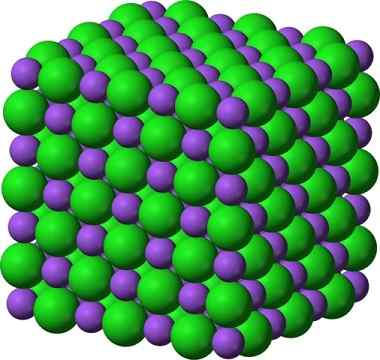 Kryštalická štruktúra chloridu sodného, NaCl
Kryštalická štruktúra chloridu sodného, NaCl Nastriekaný cukor a soľ (GLAS) zostávajú kryštalické; Jeho kryštály sa pre naše oči stali oveľa menšími. Kryštalinita tuhej látky je preto definovaná viac jej vnútornou štruktúrou, ako jej vonkajším vzhľadom alebo jej trblietkami.
[TOC]
Štruktúra kryštalických tuhých látok
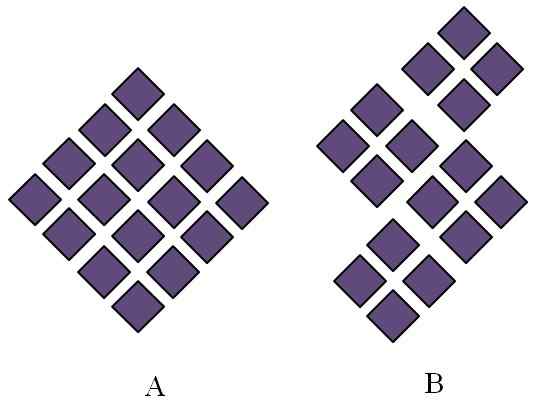 Usporiadané štruktúry kryštalických tuhých látok. Zdroj: Gabriel Bolívar.
Usporiadané štruktúry kryštalických tuhých látok. Zdroj: Gabriel Bolívar. Kryštalické tuhé látky majú objednané štruktúry. Jeho geometrické charakteristiky budú závisieť od typu kryštalickej siete, do ktorej patria, ktorá sa zase vyčnieva externe vo formách kryštálu (kryštalický systém). Vynikajúci obraz ilustruje dva dôležité pojmy takýchto štruktúr: periodicita a kryštalické zrná.
Môže vám slúžiť: dispergingová fázaPriestorový systém častíc kryštalickej tuhej látky sú noviny; to znamená, že sa opakuje znova a znova vo všetkých smeroch. To spôsobuje jeho vlastný štrukturálny vzorec pre každú pevnú a kryštalickú sieť; Napríklad tu začnú rozlišovať soľ a cukor za svoju chemickú povahu.
V kostoch sú nariadené, aby viedli k kostoru väčších rozmerov. Každá fialová kostra predstavuje časticu alebo ich sadu (atómy, ióny alebo molekuly). Dalo by sa teda očakávať, že makroskopický kryštál A má vzhľad rhomboédiky.
Medzitým sú v B komázky usporiadané takým spôsobom, že vznikajú kryštalické zrná; Sú to veľmi malé kryštály (kryštality). Potom sa hovorí, že B je polyristálna pevná látka; to znamená, že je tvorený aglomeráciou viacerých kryštalitov.
Záverom možno povedať, že tuhá látka môže byť jednoducho kryštalická (A) alebo polyristalín (B); Vo forme kryštálov, zatiaľ čo B Polyristales.
Vlastnosti
Vlastnosti kryštalických tuhých látok závisia od jeho typu skla. Je známe, že ich štruktúry sú usporiadané a že zvyčajne prezentujú vynikajúce frakcie, ktoré sa zamilujú do milovníkov minerálov. Uvádza sa však, že pevná prašná, vrátane „vypnutia“, možno tiež klasifikovať ako kryštalická.
Spôsob, akým sú ich častice priestorovo orientované, im umožňuje mať niektoré dôležité vlastnosti pre ich charakterizáciu. Napríklad kryštalické tuhé látky sú schopné difraktívnych x -rias a vytvárajú difrakčné spektrá, z ktorých je možné stanoviť mikroskopickú štruktúru kryštálu.
Podobne, pretože štruktúra je periodická, teplo sa šíri rovnakým spôsobom v celej pevnej látke; Pokiaľ medzi nimi nie sú žiadne nečistoty. Takže topenie bodov pre kryštalickú pevnú látku sú konštantné a nemenia sa bez ohľadu na to, ako sa merajú.
Môže vám slúžiť: gallium: vlastnosti, štruktúra, získanie, použitieTypy kryštalických tuhých látok
Typy kryštalických tuhých látok sú založené na tom, aký typ častíc ho skladá a aké sú ich interakcie alebo odkazy. Existujú štyri typy: iónové, kovové, molekulárne a kovalentné siete.
Aj keď predstavujú určitý stupeň nečistôt, sú naďalej kryštalické, hoci ich vlastnosti sú ovplyvnené a nevykazujú rovnaké očakávané hodnoty pre čistú pevnú látku.
Iónový
Soľ je príkladom iónovej kryštalickej pevnej látky, pretože sa skladá z NA iónov+ a cl-. Preto v tomto type tuhých látok riadi iónová väzba: sú to elektrostatické sily, ktoré riadia štrukturálny poriadok.
Kov
Všetky kovové atómy tvoria kovové kryštály. To znamená, že napríklad strieborná vidlica je konglomerátom fúzovaných strieborných kryštálov. Vnútorná alebo mikroskopická štruktúra je rovnaká v každej dlani objektu a zostáva nezmenená od rukoväte vidlice po špičku zubov.
Molekulárny
Cukor je príkladom molekulárnej kryštalickej tuhej látky, pretože je tvorený molekulami sacharózy. Preto tento typ tuhej látky pozostáva z molekúl, ktoré prostredníctvom svojich intermolekulárnych interakcií (a nekovalentných väzieb) dokážu vytvoriť usporiadanú štruktúru.
Kovalentné siete
Nakoniec máme kryštalické tuhé látky kovalentných sietí. Prevládajú kovalentné väzby, pretože sú zodpovedné za vytvorenie poriadku a udržiavanie atómov silne upevnených v príslušných pozíciách priestoru. Nehovorí sa o iónoch, atómoch alebo molekulách, ale o troch rozmerových sieťach.
Príklady
Ďalej, a nakoniec, niektoré príklady budú uvedené pre každý z typov kryštalických tuhých látok.
Môže vám slúžiť: elektronegativitaIónový
Všetky soli sú iónové pevné látky. Existujú tiež sulfidy, hydroxidy, oxidy, halogenidy a ďalšie zlúčeniny, ktoré sú tiež tvorené iónmi, alebo ich interakcie sú v iónovej podstate. Máme:
-KCL
-Prípad4
-Ba (oh)2
-Cuso4
-Fecl3
-Nat2Siež
-Mgo
-Kaviareň2
-NAHCO3
-(NH4)2Croch4
Okrem týchto príkladov sa drvivá väčšina minerálov považuje za iónové kryštalické tuhé látky.
Kov
Akýkoľvek kovový prvok je prirodzene prezentovaný ako kovové kryštály. Niektoré z nich sú:
-Meď
-Žehlička
-Hliník
-Chróm
-Kovový vodík (pod nepredstaviteľnými tlakmi)
-Volfrám
-Zirkón
-Titán
-Horčík
-Sodík
Molekulárny
Existuje široká škála molekulárnych kryštalických tuhých látok. Prakticky akúkoľvek organickú zlúčeninu, ktorá tužije, sa podarí vytvoriť kryštály, ak je jeho čistota vysoká alebo ak jej štruktúra nie je príliš zložitá. Takže máme:
-Ľad (H2Buď)
-Suchý ľad (CO2)
-Jo2
-P4
-Siež8 (a jeho polymorfy)
-Antraén
-Pevný kyslík
-Pevný amoniak
-Fenolftaleín
-Kyselina benzoová
Kovalentné siete
A nakoniec, medzi niektorými kryštalickými tuhými látkami kovalentných sietí, ktoré máme:
-diamant
-Grafit
-Nanotrubice
-Fullerenos
-Štrbina
-Kremík
-Germánsko
-Bór
Z tohto zoznamu by sa uhlíkové nanotrubice a fullerénu mohli považovať za molekulárne kryštalické tuhé látky. Dôvodom je, že hoci pozostávajú z kovalentne zjednotených atómov uhlíkov, definujú jednotky, ktoré sa dajú vizualizovať ako makromolekuly (futbalové gule a trubice).
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Wikipedia. (2020). Kryštál. Zdroj: In.Wikipedia.orgán
- Chémia librettexts. (16. júna 2019). Kryštalické a amorfné tuhé látky. Získané z: Chem.Librettexts.orgán
- Rachel Bernstein a Anthony Carpi. (2020). Vlastnosti pevných látok. Získané z: VisionLearning.com
- « Štruktúra amorfných tuhých látok, vlastnosti, príklady
- Demografické príčiny, dôsledky, výhody, nevýhody »

