Spektrálna séria
- 2468
- 159
- Tomáš Klapka
Ten Spektrálna séria Pozostávajú zo sady farebných čiar na tmavom pozadí alebo jasných pruhov oddelených tmavými oblasťami, ktoré vyžarujú svetlo od všetkých druhov látok.
Tieto čiary sa vizualizujú pomocou spektrometrov, prístroja, ktorý pozostáva z hranolu alebo jemne rozdeleného stojana, ktorý je schopný oddeliť rôzne komponenty svetla.
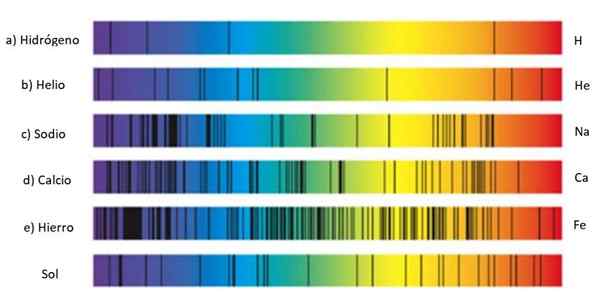
 Absorpčné spektrá rôznych látok a slnka. Zdroj: Wikmedia Commons.
Absorpčné spektrá rôznych látok a slnka. Zdroj: Wikmedia Commons. Tieto sady riadkov sa volá spektrum A každá látka má spektrum karacateristov, akýsi odtlačok prsta, ktorý slúži na identifikáciu jeho prítomnosti vo svetle, ktoré pochádza z objektu. Je to preto, že každý atóm má svoju vlastnú konfiguráciu elektrónov a povolil hladinu energie.
Preto nájdenie spektrálnych línií je technika, ktorú astronómovia široko používajú na zistenie zloženia hviezd cez svetlo, ktoré vydávajú. V skutočnosti všetko, čo astronómovia vedia o hviezdach, pochádza z ich spektra, či už z emisií alebo absorpcie.
Pôvod spektier
Prítomnosť spektier je spôsobená atómovou konfiguráciou. Elektróny v skutočnosti zostávajú okolo jadra v regiónoch zvaných Orbitáli, Nachádza sa na určitých diskrétnych vzdialenostiach od neho.
Napríklad v vodíku, najjednoduchšom prvku, orbitálne rádiá sú dané 0.053 ∙ n2 nanometre, kde n = 1, 2, 3, 4, .. . Medzi nimi nie sú povolené stredné hodnoty, takže sa hovorí, že orbitáli sú kvantifikovaný. Kvantifikuje sa aj energetický stav každého orbitálu.
Takéto obmedzenia spôsobujú, že elektróny sa správajú súčasne ako častice a tiež ako vlny, rovnako ako svetlo. Elektróny však môžu prejsť z jedného orbitalu do druhého a zmeniť energetický stav atómu.
Elektromagnetická absorpcia a emisie
Napríklad, ak elektrón prechádza z vnútornejšej orbitálu, s menšou energiou, na inú externejšiu a energickejšiu, je potrebné získať potrebnú elektromagnetickú energiu, ktorá je uložená v atóme. Tento proces sa volá absorpcia.
Na druhej strane, ak elektrón prechádza z jedného vonkajšieho orbitálu na vnútornejší. Vlnová dĺžka zodpovedá tomuto rozdielu a je daná:
Môže vám slúžiť: Orion Hmlovina: pôvod, umiestnenie, charakteristika a údaje
- E je energia
- λ je vlnová dĺžka
- H je Planckova konštanta
- C je rýchlosť svetla
Typy spektier
Existujú absorpčné aj emisné spektrá, ktoré závisia od určitých parametrov objektu alebo látky, ako je hustota a teplota. Spektrum slabého plynu sa líši od spekcie tuhej látky pri vysokej teplote.
Kontinuálne spektrum
Niektoré zdroje emitujú spektrá, ktorých farebné čiary sa menia jemne a obsahujú všetky farby. Toto sa nazýva kontinuálne spektrum, napríklad tie, ktoré vytvára vlákno žiarovky.
Emisné spektrum
Je to ten, ktorý emituje určité horúce látky a pozostáva z niekoľkých riadkov určitej vlnovej dĺžky.
Tento typ spektra sa vytvára slabými a horúcimi plynmi, ako sú tie, ktoré vyplňujú fluorescenčné trubice. Boreal Aurora je ďalším príkladom emisií, ktorá sa vyskytuje v plynoch hornej atmosféry Zeme. Vytvárajú tiež emisné spektrá niektoré medzihviezdne plynové oblaky.
Absorpčné spektrum
Toto spektrum je to, čo sa prijíma, keď sa svetlo hustého a veľmi horúceho objektu prechádza chladnejším plynom. V ňom sú pozorované takmer všetky farby, ale niektoré sa zdajú byť znížené a niektoré tmavé pruhy vznikajú v tých vlnových dĺžkach, ktoré sú absorbované atómami alebo molekulami plynu.
Kirchoff zákony spektroskopie
Kirchoffove zákony spektroskopie naznačujú, za akých podmienok sú vytvorené rôzne spektrá vyššie:
- Kontinuálne spektrá: sú emitované akýmkoľvek objektom pri vysokom tlaku a teplote.
- Emisné spektrá: Vytvárajú sa nízkym tlakom pri nízkom tlaku, ktorý emituje dobre definované vlnové dĺžky, čo zodpovedá elektronickým prechodom zodpovedajúcim každému prvku, ktorý tvorí plyn.
- Absorpčné spektrá: sú produkované plynmi pri nízkych teplotách umiestnených v blízkosti písma kontinuálneho žiarenia. Atómy plynu alebo molekuly absorbujú iba určité vlnové dĺžky.
Spektrum emisií vodíka
Emisné spektrum vodíka je obzvlášť dôležité, pretože je najhojnejším prvkom v celom vesmíre a obsahuje veľa dôležitých informácií o hviezdach a Mliečnej dráhe.
Rôzni vedci objavili línie vodíkových spektra a každý je pomenovaný.
Séria Balmer
Vodík vydáva rôzne vedenia vo viditeľnom spektre: Keď elektrón klesá z orbitálu 3 na orbitál 2, vydáva červené svetlo, ktorého vlnová dĺžka je 656.6 nm, a ak sa rozpadne z orbitálu 4 až 2, potom emituje 486 modré svetlo.1 nm.
 Emisné spektrum vodíka, zobrazujúce čiary zodpovedajúce viditeľnému svetlu a dve ultrafialové čiary vľavo. Zdroj: Wikmedia Commons.
Emisné spektrum vodíka, zobrazujúce čiary zodpovedajúce viditeľnému svetlu a dve ultrafialové čiary vľavo. Zdroj: Wikmedia Commons. V roku 1885 (predtým, ako Bohr navrhol svoju teóriu), matematik a švajčiarsky profesor Johann Balmer (1825-1898) zistil Tanteo recept na určenie vlnových dĺžok λ týchto línií:
Kde:
- R je Rydbergova konštanta: 1.097 × 107 m-1
- N = 3, 4, 5 .. ., to znamená n ≥ 3 (celé).
Napríklad pre n = 3 v Balmerovej rovnici:
Zodpovedá červenej čiare doprava, znázornená na obrázku vyššie. Objav série Balmer spôsobil, že ostatní vedci hľadali čiary vo zvyšku vodíkového spektra a iných plynov.
Séria Lyman
Všimnite si, že vodíkové spektrum znázornené na obrázku obsahuje niektoré riadky v ultrafialovej farbe, dve z extrémnej ľavice, ktorej vlnové dĺžky sú 397.0 nm a 388.9. nm.
Tieto línie v ultrafialovej farbe skutočne zodpovedajú So -Called Lymanovej sérii, ktorú objavil v roku 1906 fyzik Theodore Lyman. Jeho vzorec je:
Môže vám slúžiť: BTU (tepelná jednotka): rovnocennosti, použitia, príklady)
Paschen Series
Séria Paschen objavila nemecký fyzik Friederich Paschen v roku 1908 a platí pre n ≥ 4, to znamená: n = 4, 5, 6 ..
Paschenské čiary sa nachádzajú v blízkej infračervenej oblasti a konečná úroveň je n = 3, to znamená, že ich hodnoty sa vyskytujú, keď elektrón klesá z vyšších úrovní na n = 3. Keďže séria Lyman je v ultrafialovej farbe, dospelo sa k záveru, že séria Balmer je medzi Lymanom a Paschenom.
Séria Brackett
Táto séria objavená v roku 1922 Frederick Brackett, americký fyzik, sa nachádza vo vzdialenej infračervenej energii a pozostáva zo spektrálnych čiar zodpovedajúcich prechodom vodíka, ktoré sa začínajú pri n = 5 a pokračujú:
Séria pfundu
Séria Pfund našla v roku 1924 americký fyzik August Hermann Pfund a odkazuje na prechody, ktoré sa začínajú na n = 5, vo vzdialenej infračervenom pásme:
) Odkazy
Odkazy
- Arny, T. 2017. Prieskumy: Úvod do astronómie. 8. Edimatizovať. McGraw Hill.
- Bauer, w. 2011. Fyzika pre inžinierstvo a vedy. Zväzok 2. MC Graw Hill.
- Chang, R. 2013. Chémia. 11 VA. Vydanie. MC Graw Hill Education.
- Sears, Zemansky. 2016. Fyzika univerzity s modernou fyzikou. 14. Edimatizovať. Zväzok 2. Pearson.
- Windows otvorené do vesmíru. Rôzne druhy spektier. Obnovené z: médií4.Osud.fr.


)
m^-1=656.3&space;\:&space;nm)
)
)