Organické soli
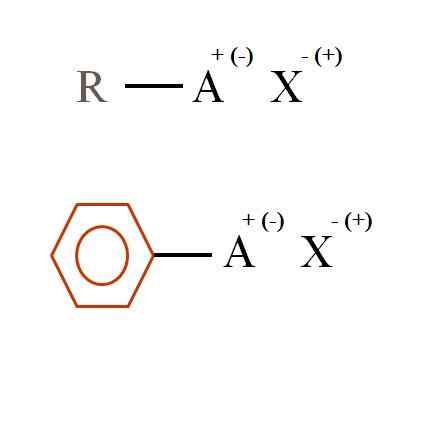
- 1258
- 334
- Gabriel Bahna
 Dva všeobecné chemické vzorce pre organické soli. Zdroj: Gabriel Bolívar
Dva všeobecné chemické vzorce pre organické soli. Zdroj: Gabriel Bolívar Čo sú organické soli?
Ten Organické soli Sú hustým počtom iónových zlúčenín s nespočetnými vlastnosťami. Predtým odvodené z organickej zlúčeniny, ktorá prešla transformáciou, ktorá jej umožňuje byť nákladom a že jeho chemická identita závisí od pridruženého iónu.
Na vynikajúcom obrázku sú pre organické soli znázornené dva veľmi všeobecné chemické vzorce. Prvý, R-AX, sa interpretuje ako zlúčenina, v ktorej uhlíkovej štruktúre atóm alebo skupina A, nosí pozitívne + alebo negatívne zaťaženie (-).
Ako je vidieť, existuje kovalentná väzba medzi R a A, R-A, ale zase má formálne zaťaženie, ktoré priťahuje (alebo odpudzuje) k iónu x. Značka záťaže bude závisieť od povahy A a chemického prostredia.
Keby to bolo pozitívne, koľko X mohlo interagovať? S jedným, vzhľadom na princíp elektroneutrality (+1-1 = 0). Aká je však identita x? Anión X by mohol byť CO32-, Vyžaduje si dva katióny RA+; Halogenid: f-, Cl-, Br-, atď.; alebo dokonca iná zlúčenina-. Možnosti sú nevyčísliteľné.
Podobne môže byť organická soľ aromatická, ilustrovaná v benzénom hnedom kruhu. Soľ meďnatého benzoátu (II), (C6H5Coo)2Napríklad Cu pozostáva z dvoch aromatických krúžkov s negatívne naloženými karboxymi, ktoré interagujú s katiónom Cu2+.
Fyzikálne a chemické vlastnosti organických solí
Z obrázka je možné potvrdiť, že organické soli pozostávajú z troch komponentov: organické, R alebo AR (aromatický kruh), atóm alebo skupinový nosič iónového zaťaženia A a protiion x.
Rovnako ako chemická identita a štruktúra sú definované takýmito komponentmi, rovnako ako ich vlastnosti závisia od nich.
Z tejto skutočnosti možno zhrnúť určité všeobecné vlastnosti, ktoré spĺňajú drvivú väčšinu týchto solí.
Môže vám slúžiť: Oxidačné číslo: Koncept, ako to dostať von a príkladyVysoká molekulárna hmotnosť
Organické soli majú za predpokladu, že mono alebo všestranné anorganické anióny majú zvyčajne oveľa väčšie molekulárne hmoty ako anorganické solí. Je to hlavne kvôli sýtenej kostru, ktorej jednoduché väzby C-C a jeho atómy vodíka poskytujú zlúčenine veľa hmotnosti.
Preto sú zodpovední za svoje vysoké molekulárne hmoty.
Amfifylické a povrchovo aktívne látky
Organické soli sú amfifilné zlúčeniny, to znamená, že ich štruktúry majú hydrofilné aj hydrofóbne extrémy.
Aké sú také extrémne? R alebo AR predstavuje hydrofóbny koniec, pretože ich atómy C a H nemajú veľkú afinitu k molekulám vody.
Do+(-), Skupina atómu alebo nákladného nosiča je hydrofilný koniec, pretože prispieva k dipólovému momentu a interaguje s dipólom tvoriacou vodu (RA (RA+ Oh2).
Keď sú hydrofilné a hydrofóbne oblasti polarizované, amfifilná soľ sa stáva povrchovo aktívnou látkou, čo je látka široko používaná na vypracovanie detergentov a prerušujúci.
Vysoké body varu alebo fúzia
Rovnako ako anorganické soli, aj organické soli majú tiež vysoké topiace sa a varné body kvôli elektrostatickým silám, ktoré sa riadia v kvapalnej alebo tuhej fáze.
Avšak s organickou zložkou R alebo AR sa nejakým spôsobom zúčastňujú ďalšie typy van der Waals (Londýn, dipolo-dipolo, vodíkové mosty).
Z tohto dôvodu sú tuhé alebo kvapalné štruktúry organických solí v prvom rade zložitejšie a rozmanitejšie. Niektorí z nich sa môžu dokonca správať ako tekuté kryštály.
Kyslosť a základnosť
Organické soli sú zvyčajne silnejšie kyseliny alebo bázy ako anorganické soli. Je to preto, že napríklad v amínových solich má kladné zaťaženie kvôli svojmu prepojeniu s ďalším vodíkom: a+-H. Potom v kontakte so základňou darujte protón tak, aby bol neutrálnou zlúčeninou:
Môže vám slúžiť: strontium: História, štruktúra, vlastnosti, reakcie a použitiaRana+H + b => ra + hb
H patrí do A, ale je napísané, pretože zasahuje do neutralizačnej reakcie.
Na druhej strane, ra+ Môže to byť veľká molekula, ktorá nie je schopná tvoriť tuhé látky s kryštalickou sieťou stabilnou s hydroxyl anión alebo oxhydrilo OH-.
Keď je to tak, soľný baran+Oh- Správa sa ako silná základňa; Dokonca aj tak základné ako NaOH alebo Koh:
Rana+Oh- + HCl => RACL + H2Ani
V chemickej rovnici si všimnite, že anión Cl- vymeňte OH-, Vytváranie soli RA+Cl-.
Použitie organických solí
Použitie organických solí sa bude líšiť v závislosti od identity R, AR, A a X. Navyše, aplikácia, na ktorú sa prideľujú, tiež závisí od typu pevnej alebo kvapaliny, ktorú tvoria. V tejto súvislosti sú niektoré všeobecnosti:
- Slúžia ako činidlá na syntézu iných organických zlúčenín. Rax môže pôsobiť ako „darca“ reťazca R, ktorý pridá do inej zlúčeniny, ktorá nahrádza dobrú odchádzajúcu skupinu.
- Sú to povrchovo aktívne látky, takže sa dajú použiť aj ako mazivo. Na tento účel sa používajú kovové karboxylalátové soli.
- Umožňujú syntetizovať širokú škálu farbív.
Príklady organických solí
Karboxyláty
Karboxylové kyseliny reagujú s hydroxidom pri neutralizačnej reakcii, čo spôsobuje karboxylalátové soli: RCOO- M+; kde m+ Môže to byť akýkoľvek kovový katión (NA+, Pb2+, Klimatizovať+, atď.) alebo katión amónneho4+.
Mastné kyseliny sú dlhé karboxylové kyseliny, môžu byť nasýtené a nenasýtené. Kyselina palmitová patrí medzi nasýtené (vyberte si3(Ch2)14Cooh). To vzniká zo soli palmitátu, zatiaľ čo kyselina stearová (CHO3(Ch2)16CoOH tvorí stear soľ. Z týchto solí sú zložené mydlá.
Môže vám slúžiť: Všeobecný plynový zákonV prípade kyseliny benzoovej, C6H5Cooh (kde c6H5- Je to benzénový krúžok), keď reaguje so základňou, tvorí soli benzoátu. Vo všetkých karboxilatátoch skupina -Co- Predstavuje (rax).
Lítium diaquilcupratos
Lítiový deň je užitočný pri organickej syntéze. Jeho vzorec je [R-Cu-R]-Li+, v ktorom atóm medi nesie negatívne zaťaženie. Tu meď predstavuje atóm obrázka.
Sulfónové soli
Vytvárajú sa z reakcie organického sulfidu alkyl halogenidom:
R2S + r'x => r2R+X
Pre tieto soli nesie atóm síry kladné formálne zaťaženie (S+) mať tri kovalentné odkazy.
Oxyio soli
Podobne aj étery (okysličené analógy sulfidov) reagujú s hydraceidmi za vzniku kyslíkových miestností:
Ror ' + hbr ro+Hr ' + br-
Protón kyseliny HBR je dôsledne spojený s atómom kyslíka éteru (r (R2Ani+-H), nabíjanie pozitívne.
Amina soli
Amíny môžu byť primárne, sekundárne, terciárne alebo kvartérne, rovnako ako ich soli. Všetky sa vyznačujú tým, že majú atóm H spojeného s atómom dusíka.
Tak, rnh3+X- Je to primárna amínová soľ; R2NH2+X-, sekundárnej Aminy; R3NH+X-, terciárneho amínu; a r4N+X-, kvartérneho amínu (kvartérna amónna soľ).
Diazonium soli
Nakoniec diazonium soli (RN2+X-alebo arildiazonium (RNA2+X-), predstavujú východiskový bod mnohých organických zlúčenín, najmä azoických farbív.
Odkazy
- Francis a. Korytnačka. Organická chémia (šieste vydanie, s. 604-605, 697-698, 924). MC Graw Hill.
- Graham Solomons t.W., Craig B. Fryhle. Organická chémia. Amíny (10. vydanie.). Wiley Plus.
- Wikipedia (2018). Soľ (chémia). Prevzaté z: v.Wikipedia.orgán
- Steven a. Hardinger (2017). Ilustrovaný slovník organickej chémie: soli. Získané z: Chem.UCLA.Edu
- Chevron Oronite (2011). Karboxyláty. [PDF]. Získané z: Oronite.com

