Renio Discovery, Vlastnosti, štruktúra, použitie

- 4447
- 678
- MUDr. Žigmund Boška
On Renalio Je to kovový prvok, ktorého chemický symbol je RE a je umiestnený v skupine 7 periodickej tabuľky, dve pozície pod mangánom. Zdieľajte s tým a vlastníctvom viacerých čísel alebo oxidačných stavov, od +1 do +7. Tiež tvorí anión nazývaný perrenato, väzňa4-, Analogický k permanganátu, MNO4-.
Tento kov je jedným z najzaujímavejších a zriedkavejších prírody, takže jeho cena je vysoká. Extrahuje sa ako vedľajší produkt molybdénu a ťažby medi. Jedným z najdôležitejších vlastností Renio je jeho vysoký bod topenia, sotva prekonaný uhlíkom a volfrámom a jeho veľká hustota, ktorá je dvojnásobkom olova.
 Renio Metal Sphere. Zdroj: Hi-res obrázky chemických prvkov/cc od (https: // creativeCommons.Org/licencie/o/3.0)
Renio Metal Sphere. Zdroj: Hi-res obrázky chemických prvkov/cc od (https: // creativeCommons.Org/licencie/o/3.0) Jeho objav má kontroverzné a nešťastné nuansy. Názov „Renio“ pochádza z latinského slova „rhenus“, čo znamená Rin, slávna nemecká rieka v blízkosti miesta, kde nemeckí chemici, ktorí izolovali a identifikovali tento nový prvok.
Renio má početné využitie, medzi ktorými je vylepšenie oktánu benzínových stánkov.
[TOC]
Objavenie
Existencia dvoch ťažkých prvkov s chemickými charakteristikami podobnými charakteristikám mangánu už predpovedala od roku 1869 prostredníctvom pravidelnej tabuľky ruského chemika Dmitri Mendeleev. Vtedy však nebolo známe, aké by mali byť ich atómové čísla; A to bolo v roku 1913, keď bola predstavená predpoveď anglického fyzika Henryho Moseleyho.
Podľa Moseleyho musia mať tieto dva prvky patriace do skupiny mangánov atómové čísla 43 a 75.
Pred pár rokmi však japonský chemik Masataka Ogawa objavil údajný prvok 43 vo vzorke minerálnej Torianity. Po oznámení svojich výsledkov v roku 1908 chcel krstiť tento prvok menom „NIPONIO“. Bohužiaľ, chemici v tom čase ukázali, že Ogawa neobjavil prvok 43.
Môže vám slúžiť: cykloalky: chemická štruktúra, vlastnosti, nomenklatúraA tak, ďalšie roky uplynuli, keď v roku 1925 tri nemeckí chemici: Walter Noddack, Ida Noddack a Otto Berg, našli prvok 75 v Columbite, gadolinit a minerálnych vzorkách minerálov molybdenit. Dali mu meno Renio na počesť nemeckého Rina Rin („Rhenus“ v latinčine).
Chyba Masataka Ogawa bola v identifikácii prvku rozpadu: objavil Renio, nie prvok 43, ktorý sa dnes nazval Tecnocio.
Renio Vlastnosti
 Situácia Renio v periodickej tabuľke. !Originál: AhoteseierVector: Sushant Savla/CC By-S (https: // creativeCommons.Org/licencie/By-SA/3.0)
Situácia Renio v periodickej tabuľke. !Originál: AhoteseierVector: Sushant Savla/CC By-S (https: // creativeCommons.Org/licencie/By-SA/3.0) Fyzický vzhľad
Renio sa zvyčajne uvádza na trh vo forme sivého prachu. Jeho kovové kúsky, zvyčajne sférické kvapky, sú strieborné šedé, ktoré sú tiež veľmi jasné.
Molárna hmota
186,207 g/mol
Atómové číslo
75
Bod topenia
3186 ° C
Bod varu
5630 ° C
Hustota
-Pri izbovej teplote: 21,02 g/cm3
-Priamo v bode topenia: 18,9 g/cm3
Renio je kov, ktorý je takmer dvakrát hustý ako ten istý olovo. Renio guľa, ktorá váži 1 gram, sa teda dá vyrovnať robustným oloveným kryštálom rovnakej hmoty.
Elektronegativita
1.9 v Pauling Scale
Ionizačné energie
Prvé: 760 kJ/mol
Po druhé: 1260 kj/mol
Tretia: 2510 kj/mol
Kapacita moláru
25,48 J/(mol · k)
Tepelná vodivosť
48,0 w/(m · k)
Elektrický odpor
193 NΩ · m
Mohs tvrdosť
7
Izotopy
Atómy Renio sú v prírode prezentované ako dva izotopy: 185Re, s množstvom 37,4%; a 187Re, s množstvom 62,6%. Renio je jedným z tých prvkov, ktorých najhojnejší izotop je rádioaktívny; Avšak čas medzi život 187RE je veľmi veľký (4,12,1010 roky), takže sa prakticky považuje za stabilný.
Môže vám slúžiť: nikel: História, vlastnosti, štruktúra, použitie, rizikáReaktivita
Kovový renio je materiál odolný voči oxidácii. Keď to urobí, jeho oxid, re2Ani7, Je volatilizovaný pri vysokých teplotách a horí so žltkastým zeleným plameňom. Renioove kúsky odolávajú útoku HNO3 koncentrované; Ale horúce, rozpúšťa sa, aby sa vytvorila kyselina žínová kyselina a oxid dusíka, ktorý roztok hnedá:
Re + 7Hno3 → Hreo4 + 7 Nie2 + 3h2Ani
Renioova chémia je rozsiahla, pretože je schopná tvoriť zlúčeniny so širokým spektrom oxidačných čísel, ako aj vytvorenie kvadrupólovej väzby medzi dvoma atómami Renio (štyri opätovne kovalentné väzby).
Elektronická štruktúra a konfigurácia
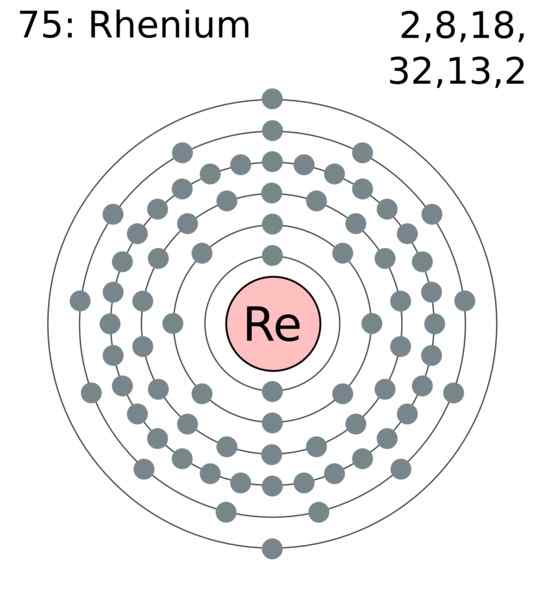 Elektrónová vrstva. Autor: Používateľ: GREGROBSON (Greg Robson). Wikimedia Commons
Elektrónová vrstva. Autor: Používateľ: GREGROBSON (Greg Robson). Wikimedia Commons Atómy Renio sú zoskupené do ich kryštálov, aby spôsobili kompaktnú šesťuholníkovú štruktúru HCP, ktorá sa vyznačuje veľmi hustou. To súhlasí so skutočnosťou, že je kov s veľkou hustotou. Kovové spojenie, produkt prekrývania svojich vonkajších orbitálov, udržuje atómy silne súdržné.
V tomto kovovom spojení sa zúčastnia elektróny Valencie, ktoré sú podľa elektronickej konfigurácie:
[Xe] 4f14 5 D5 6s2
V zásade je to orbitály 5D a 6S, ktoré sa prekrývajú, aby zhutnili atómy RE v štruktúre HCP. Všimnite si, že vaše elektróny pridávajú celkom 7, čo zodpovedá číslu vašej skupiny v periodickej tabuľke.
Oxidácia
Elektronická konfigurácia Renio raz pozriek, že jeho atóm je schopný stratiť až 7 elektrónov, aby sa stal hypotetickým katiónom7+. Keď sa predpokladá existencia RE7+ V akejkoľvek zlúčenine Renio, napríklad v RE2Ani7 (Re27+Ani72-), Hovorí sa, že má oxidačné číslo +7, re (vii).
Ďalšie pozitívne oxidačné čísla pre Renio sú: +1 (RE+), +2 (re2+), +3 (re3+) A tak ďalej na +7. Renio tiež môže získať elektróny a stať sa aniónom. V týchto prípadoch sa hovorí, že má negatívne oxidačné číslo: -3 (RE3-), -2 (re2-) a -1 (re-).
Môže vám slúžiť: Hydrolýza: Čo je to a príklady reakciíŽiadosti
Benzín
Renio, spolu s platinou, sa používa na vytvorenie katalyzátorov, ktoré zvyšujú stupeň oktánu benzínu, zatiaľ čo znižuje jeho obsah olova. Na druhej strane sú katalyzátory Renio určené pre viacnásobné hydrogenácie, to je spôsobené ich rezistenciou na otravu dusík, fosfor a sulfur.
Žiaruvzdorné superleacie
Renio je refraktérny kovový produkt svojho vysokého bodu topenia. Z tohto dôvodu sa pridávajú zliatiny niklu, aby sa otočili žiaruvzdorné a odolné voči veľkým tlakom a teplotám. Tieto superleacie sa väčšinou používajú na návrh turbín a motorov pre letecké lode.
Volfrámové vlákna
Renio môže tiež tvoriť zliatiny s volfrámom, čo zlepšuje jeho ťažnosť, a preto uľahčuje výrobu vlákien. Tieto vlákna Renio-Tungsten sa používajú ako röntgenové zdroje a na návrh termokuplaí schopných merať teploty do 2200 ° C.
Podobne sa tieto vlákna Renio použili raz pre archaické kamery a momentálne pre sofistikované lampy zariadenia; ako je hmotnostný spektrofotometer.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Sarah Pierce. (2020). Rénium: použitie, história, fakty a izotopy. Štúdium. Získané z: štúdie.com
- Národné centrum pre biotechnologické informácie. (2020). Rénium. Databáza pubchem., CID = 23947. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Wikipedia. (2020). Rénium. Zdroj: In.Wikipedia.orgán
- DR. Doug Stewart. (2020). Fakty prvkov réniu. Získané z: Chemicool.com
- Eric Scerri. (18. novembra 2008). Rénium. Chémia vo svojich prvkoch. Získané z: Chemistryworld.com

