Pravidlo umývadla alebo maximálna multiplicita

- 4125
- 1114
- Valentín Dula
Vysvetlíme, čo je pravidlo Hund alebo zásada maximálnej multiplicity, kroky na jeho uplatňovanie a uvádzanie niekoľkých príkladov
 Zdroj: Gabriel Bolívar
Zdroj: Gabriel Bolívar Aké je pravidlo umývadla?
Ten Pravidlo, Nazýva sa tiež maximálny princíp multiplicity rotácie, je to empirické pravidlo, ktoré sa používa na písanie absolútnej elektronickej konfigurácie chemických prvkov, keď sú vo svojom základnom stave. To znamená, že je to pravidlo, ktoré pomáha predpovedať, ako sú elektróny distribuované na atómových orbitáloch atómu, ktorý je uvoľnený alebo na najnižšej úrovni energie.
Sink's Rule hovorí:
„… V atóme, ktorý je v jeho základnom stave, budú elektróny rovnakej energetickej úrovne distribuované takým spôsobom, že existuje čo najviac paralelných osôb“.
Toto pravidlo zodpovedá jednému zo základných princípov kvantovej mechaniky a súčasnej atómovej teórie. Je veľmi užitočné porozumieť niektorým vlastnostiam rôznych prvkov, najmä ich magnetických vlastností. Je to preto, že atómy priťahujú alebo odpudzujú magnety, pretože zmizli elektróny vo svojej štruktúre.
Odkiaľ pochádza umývadlo alebo maximálne pravidlo multiplicity?
Atómové spektrá
Tento princíp prvýkrát vyhlásil nemeckého fyzika Friedricha Hunda v roku 1927. Umývadlo študované atómové absorpčné spektrá, ktoré umožňujú experimentálne meranie energie, ktorú elektróny absorbujú, keď sú vystavené elektromagnetickému žiareniu primeranej vlnovej dĺžky. Experimentálne pozorovania možno vysvetliť iba vtedy, ak atóm má čo najviac elektrónov s rovnakým rotáciou.
Chýbajúce elektróny
Okrem atómových spektier existujú aj ďalšie experimentálne pozorovania, ktoré potvrdzujú elektronické konfigurácie, ktoré sa predpovedajú použitím pravidla Hund. Najdôležitejšie pozostáva z experimentálnych miery magnetických vlastností atómov, ktoré umožňujú určiť, koľko chýbajúcich elektrónov má atóm.
Môže vám slúžiť: elektrolýza vodyChýbajúce elektróny sú tie, ktoré sú sami v orbitáli, bez toho, aby ich oslovil protiútokový pár.
Kroky na uplatnenie pravidla umývadla
Pravidlo umývadla platí, keď píšeme elektronickú konfiguráciu atómu v jeho základnom stave. To znamená, že ide o doplnkové pravidlo iných pravidiel, ako je princíp AUFBAU alebo zásada výstavby (nazývané aj dažďové pravidlo) a zásada vylúčenia Pauliho.
Sa vzťahuje iba na prípady, v ktorých chceme.
Okrem toho má zmysel iba ju aplikovať na vrstvu Valencie, to znamená, že úroveň energie, ktorá je neúplná (nemá všetky elektróny, ktoré sa do nej zmestia). V opačnom prípade by boli všetky elektróny spárované, aby boli v súlade s Pauliovým vylúčením.
Uplatňovanie tohto pravidla pozostáva z nasledujúcich krokov:
- Krok 1: Nakreslite vodorovnú čiaru alebo malý obdĺžnik pre každú orbitálnu úroveň.
- Krok 2: Umiestnite prvý elektrón do prvého orbitálu, ktorý smeruje.
- Krok 3: Do nasledujúceho orbitálu umiestnite nasledujúci elektrón, ktorý tiež ukazuje.
- Krok 4: Pokračujte takto, kým elektróny neskončia alebo už nie sú prázdne orbitály.
- Krok 5: Ak pri umiestňovaní elektrónu do každej orbitálu sú stále elektróny, ktoré sa majú distribuovať, zopakujte kroky 2 až 4, ale umiestnite elektróny pomocou ich spinu smerujúcej dole.
Aby sme pochopili, ako sa tieto kroky uplatňujú, analyzme niekoľko príkladov.
Príklad 1: Elektronická konfigurácia dusíka
Dusík je prvok číslo 7, takže má celkom 7 elektrónov, ktoré sa točia okolo jadra. Tieto elektróny sú distribuované takto podľa pravidla dažďa:
Môže vám slúžiť: acetanylid (C8H9No)1s2 2s2 2 P3
Ako vidíme, vrstva valencie dusíka zodpovedá úrovni 2 energie (nazývaná vrstva L), v ktorej sa 8 elektrónov zmestia. Avšak dusík má iba 5 elektrónov vo Valencii.
Na orbitáloch siež Iba 2 elektróny sa hodia, takže orbitál 2S je úplne plný a nemá zmysel uplatňovať pravidlo umývadla pre tento orbitál.
Na druhej strane, sub -úroveň 2P, ktorá obsahuje 3 orbitály, nie je plná. Ale ako sa tieto 3 elektróny distribuujú na týchto troch orbitáloch? Distribuujú sa podľa krokov pravidla umývadla, ktoré sú uvedené nižšie:
Krok 1: Nakreslite vodorovnú čiaru alebo malý obdĺžnik pre každú orbitálnu úroveň.
Pretože je to sub -úroveň 2P, existujú tri orbitály, ktoré sú 2pX, 2 Pa a 2pz. Musíme teda nakresliť tri vodorovné pruhy alebo tri škatule alebo obdĺžniky:
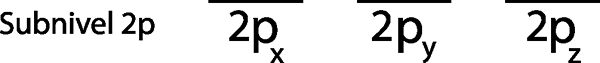
Každý z týchto pruhov alebo škatúľ predstavuje orbitál, ako je uvedené menom, ktorý každú z nich má.
Krok 2: Umiestnite prvý elektrón do prvého orbitálu, ktorý smeruje.
Prvý elektrón umiestnime do orbitálu 2pX Pretože je to prvý orbitál v zozname.
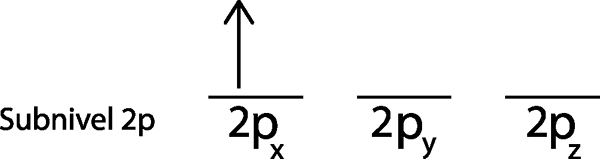
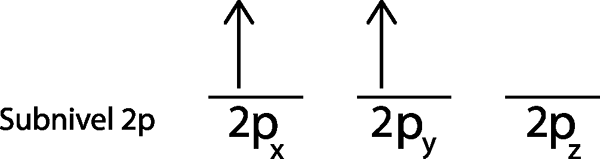
Krok 3: Do nasledujúceho orbitálu umiestnite nasledujúci elektrón, ktorý tiež ukazuje.
Druhý elektrón sa nachádza v orbitáli 2pa
Krok 4: Pokračujte takto, kým elektróny neskončia alebo už nie sú prázdne orbitály.
V našom prípade musíme iba distribuovať 3 elektróny, takže potrebujeme umiestniť posledný elektrón do poslednej orbitálnej a voila:
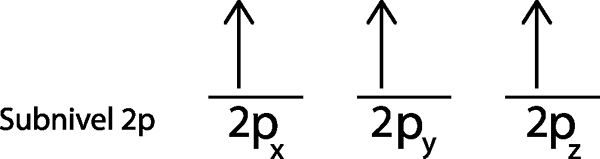
Ako je zrejmé, princíp maximálnej multiplicity alebo pravidla umývadla predpovedá, že atómový dusík musí mať 3 chýbajúce elektróny.
Môže vám slúžiť: oxidy dusíka (NOx)V tomto prípade nebolo potrebné uplatňovať krok 5, pretože po kroku 4 sme zostali bez elektrónov na distribúciu.
Príklad 2: Elektronická konfigurácia železa
Železo je prvkom 26 a jeho elektronická konfigurácia je:
1s2 2s2 2 P6 3s2 3p6 3D6 4s2
V tomto prípade si môžeme poznamenať, že orbitál s najvyššou úrovňou energie je 4s, ale pretože je to prechodný kov, železo má čiastočne plné orbitálne d. Toto je orbitál, ktorého elektróny budeme distribuovať podľa pravidla Hund.
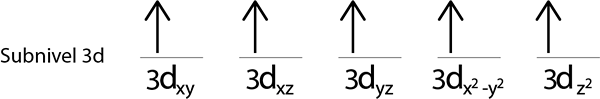
Krok 1: Nakreslite vodorovnú čiaru alebo malý obdĺžnik pre každú orbitálnu úroveň.
Vyplníme 3D sub -úroveň, ktorá obsahuje 5 orbitálov:
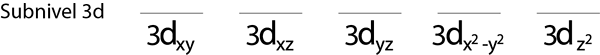
Krok 2: Umiestnite prvý elektrón do prvého orbitálu, ktorý smeruje.
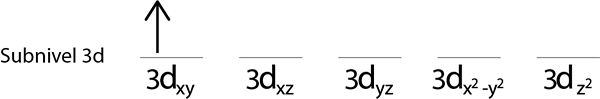
Krok 3: Vložte nasledujúci elektrón do nasledujúceho orbitálu, ktorý tiež ukazuje.
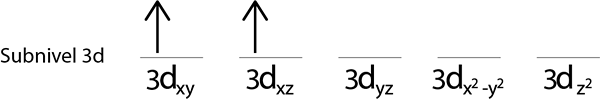
Krok 4: Pokračujte takto, kým elektróny neskončia alebo už nie sú prázdne orbitály.
Krok 5: Ak pri umiestňovaní elektrónu do každej orbitálu sú stále elektróny, ktoré sa majú distribuovať, zopakujte kroky 2 až 4, ale umiestnite elektróny pomocou ich spinu smerujúcej dole.
Keďže stále máme elektrón na distribúciu po umiestnení elektrónu do každej 3D orbitálu, posledný zo 6 elektrónov je umiestnený s opačným rotám v prvom orbitáli.
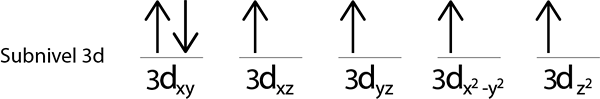
Toto je absolútna konfigurácia atómu železa v jeho základnom stave. V tom istom má železo 4 chýbajúce elektróny s paralelnými chrbticami.
Odkazy
- Bez odpovede na otázky týkajúce sa maximálneho multiplicity alebo pravidla umývadla: Čo by sa malo urobiť (2020). Prevzaté z Physis andquimica.com.
- Sink - Chemistry (2021). Prevzaté z Cencesproject.orgán.
- Maximálna multiplicita SIND (2020). Prevzatý z kniežat.com.
- Pravidlo umývadla Sprievodca chémou (2012). Prevzaté z chémie.LAGUIA2000.com.

