Exergonické reakčné charakteristiky a príklady

- 2909
- 384
- Mgr. Pravoslav Mokroš
A exergonická reakcia Je to ten, ktorý sa vyskytuje spontánne a ktorý je vo všeobecnosti sprevádzaný uvoľňovaním energie, buď vo forme tepla, svetla alebo zvuku. Keď sa teplo uvoľní, hovorí sa, že čelíme exotermickej a exergonickej reakcii.
Z tohto dôvodu sú výrazy „exotermické“ a „exergonické“ zmätené a mylne sa považujú za synonymá. Je to preto, že mnoho exotermických reakcií je tiež exergonické. Preto, ak sa pozoruje veľké odlúčenie tepla a svetla, napríklad pôvod ohňa, možno predpokladať, že pozostáva z exergonickej reakcie.
 Spaľovanie dreva je príkladom exotermickej a súčasne exergonickej reakcie. Zdroj: pixnio.
Spaľovanie dreva je príkladom exotermickej a súčasne exergonickej reakcie. Zdroj: pixnio. Uvoľnená energia však môže zostať nepovšimnutá a nie je taká prekvapujúca. Napríklad kvapalné médium sa môže mierne zahriať a napriek tomu bude dôsledkom exergonickej reakcie. V niektorých exergonických reakciách, ktoré prechádzajú príliš pomaly, nie je ani pozorované zvýšenie teploty najnižšej teploty.
Ústredným a charakteristickým bodom tohto typu termodynamických reakcií je zníženie voľnej energie Gibbs vo výrobkoch s ohľadom na reagenty, čo sa premieta do spontánnosti.
[TOC]
Charakteristiky exergonických reakcií
Všeobecný diagram
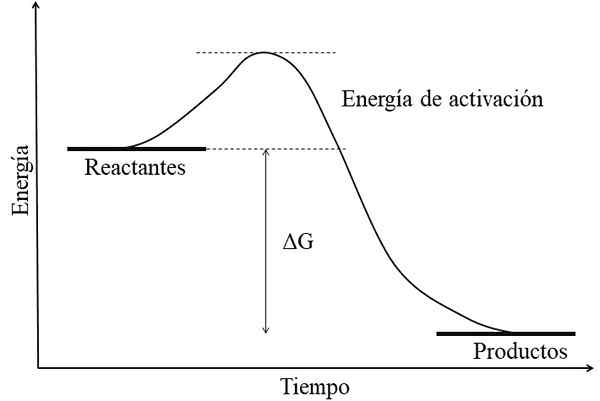 Energetický diagram pre exergonickú reakciu. Zdroj: Gabriel Bolívar.
Energetický diagram pre exergonickú reakciu. Zdroj: Gabriel Bolívar. Hlavnou charakteristikou exergonickej reakcie je, že výrobky majú voľnú energiu Gibss nižšie ako v reaktantoch alebo reagentoch (vynikajúci obraz). Táto skutočnosť je zvyčajne spojená s výrobkami je chemicky stabilnejšia, so silnejšími prepojeniami, dynamickejšími štruktúrami alebo „pohodlnejšími“ podmienkami.
Preto je tento energetický rozdiel, AG, negatívny (Ag < 0). Al ser negativa, la reacción en teoría debe ser espontánea. Sin embargo, otros factores también definen dicha espontaneidad, como lo son la energía de activación (la altura de la colina), la temperatura, y los cambios de entalpía y entropía.
Môže vám slúžiť: homogénny systémVšetky tieto premenné, ktoré reagujú na povahu fenoménu alebo uvažovanú chemickú reakciu, umožňujú určiť, či bude reakcia exergonická. A tiež bude vidieť, že to nemusí byť nevyhnutne exotermická reakcia.
Ak je aktivačná energia veľmi vysoká, reaktanty vyžadujú pomoc katalyzátora na zníženie uvedenej energetickej bariéry. Preto existujú exergonické reakcie, ktoré sa dajú veľmi nízkymi rýchlosťami alebo ktoré sa vôbec nevyskytujú na prvom mieste.
Zníženie voľnej energie v systéme
Nasledujúci matematický výraz zahŕňa to, čo je uvedené vyššie:
ΔG = ΔH - TAS
Termín AH je pozitívny, ak ide o endotermickú reakciu a negatívny, ak je exotermický. Ak chceme, aby AG bol negatívny, pojem T5 musí byť veľmi veľký a pozitívny, takže pri odpočítaní AH je výsledok operácie tiež negatívny.
Preto, a to je ďalšia osobitná charakteristika exergonických reakcií: naznačujú veľkú zmenu v entropii systému.
Zohľadnenie všetkých výrazov teda môžeme byť prítomní pred exergonickou reakciou, ale zároveň endotermická; to znamená s pozitívnym ΔH veľmi vysokou teplotou alebo zmenou veľkej entropie.
Väčšina exergonických reakcií je tiež exotermická, pretože ak je AH negatívna, a odpočítaním ďalšieho ešte negatívnejšieho pojmu budeme mať preto AG so zápornou hodnotou; Pokiaľ nie je TAS negatívny (entropia zostupuje), a preto by sa exotermická reakcia stala endogonickou (nie spontánnou).
Je dôležité zdôrazniť, že spontánnosť reakcie (či už exergonických alebo nie), do značnej miery závisí od termodynamických podmienok; Zatiaľ čo rýchlosť, s ktorou prechádza, je spôsobená kinetickými faktormi.
Môže vám slúžiť: Living Matter: Koncept, charakteristiky a príkladySpontánnosť exergonickej reakcie
To, čo sa hovorí, je známe, pretože exergonická reakcia je spontánna, či už exotermická. Napríklad zlúčenina sa môže rozpustiť vo vode, ktorá ju ochladzuje spolu s nádobou. Tento proces rozpustenia je endotermický, ale keď sa to stane spontánne, hovorí sa, že je exergonický.
Exotermická reakcia
Existujú „viac exergonické“ reakcie ako iné. Aby som to zistil, mal by byť k dispozícii nasledujúci výraz:
ΔG = ΔH - TAS
Najexergonické reakcie sú tie, ktoré sa spontánne podávajú všetkým teplotám. To znamená, bez ohľadu na hodnotu T v predchádzajúcej expresii, AH je negatívny a AS pozitívny (AH 0). Sú preto veľmi exotermické reakcie, ktoré nesúvisia s počiatočnou myšlienkou.
Môžu sa vyskytnúť aj exotermické reakcie, pri ktorých klesá entropia systému (δs < 0); tal como sucede en la síntesis de macromoléculas o polímeros. En este caso, son reacciones exergónicas solamente a bajas temperaturas, ya que de lo contrario el término TΔS sería muy grande y negativo.
Endotermická reakcia
Na druhej strane existujú reakcie, ktoré sú iba spontánne pri vysokých teplotách: keď je AH pozitívny a pozitívny (AH> 0 a δs> 0). Hovoríme o endotermických reakciách. Z tohto dôvodu sa môžu vyskytnúť teplotné zostupy spontánne, pretože majú zvýšenie entropie.
Medzitým existujú reakcie, ktoré nie sú vôbec exergonické: keď ΔH a AS majú pozitívne hodnoty. V tomto prípade, bez ohľadu na teplotu, reakcia sa nikdy nevyskytuje spontánne. Potom hovoríme o koncovej koncovej reakcii.
Môže vám slúžiť: dispergingová fázaPríklady exergonických reakcií
Chémia sa zvyčajne vyznačuje výbušnou a brilantnou, takže sa predpokladá, že väčšina reakcií je exotermická a exergonická.
Spaľovanie
Exergonické reakcie sú spaľovanie alkánov, olefínov, aromatických uhľovodíkov, cukrov atď.
Oxidax kovu
Podobne sú oxidácie kovov exergonické, aj keď prechádzajú pomalšie.
Katabolické reakcie organizmu
Existujú však ďalšie jemnejšie procesy, ktoré sú tiež exergonické a veľmi dôležité: katabolické reakcie nášho metabolizmu. Tu makromolekuly rozkladajú, ktoré pôsobia ako energetické nádrže, uvoľňujú sa v horúčave a ATP a vďaka ktorému telo vykonáva mnoho svojich funkcií.
Najpriamejším z týchto reakcií je bunkové dýchanie, oproti fotosyntéze, kde sa uhľohydráty s kyslíkom „spália“, aby sa ich transformovalo na malé molekuly (CO (CO2 a h2O) a energia.
Ďalší
Medzi ďalšími exergonickými reakciami máme výbušný rozklad dusíka triayoduro, alebo3; pridanie vodných alkalických kovov, po ktorých nasleduje výbuch; polymérna syntéza etoxylovaných živíc; Neutralizácia kyseliny vo vodnom roztoku; a luminiscenčné chemo reakcie.
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Walter J. Moore. (1963). Fyzikálna chémia. V chemickej kinetike. Štvrté vydanie, Longmans.
- Irán. Levine. (2009). Princípy fyzikálneho spôsobu. Šieste vydanie, strana 479-540. MC Graw Hill.
- Wikipedia. (2020). Exergonická reakcia. Zdroj: In.Wikipedia.orgán
- HelMestine, Anne Marie, PH.D. (16. september 2019). Endergonic vs Exergonic reakcia a proces. Zotavené z: Thoughtco.com
- Exergonická reakcia: Definícia a príklad. (18. september 2015). Získané z: štúdie.com
- Khanská akadémia. (2018). Energia. Obnovené z: je.Khanacademy.orgán
- « Mechanické vzorce energie, koncept, typy, príklady, cvičenia
- Udržateľná spotreba pre to, čo je použitie, dôležitosť, akcie, príklady »

