Endergonická reakcia

- 4699
- 779
- Blažej Hrmo
 Endary React je taká, že sa neopontánne a to vyžaduje veľa energie
Endary React je taká, že sa neopontánne a to vyžaduje veľa energie Čo je konečná reakcia?
A Endergonická reakcia Je to ten, ktorý nie je spontánny a tiež vyžaduje dodávku s vysokou energiou. V chémii je táto energia zvyčajne kalorická. Najznámejšie zo všetkých endotermických reakcií sú endotermické reakcie, to znamená tie, ktoré absorbujú teplo, ktoré sa vyskytujú.
Dôvod, prečo nie sú všetky reakcie spontánne, je to, že konzumujú energiu a systémy tvorené druhmi znižujú ich entropiu. Inými slovami, na chemické účely sa stávajú molekulárne usporiadanejšími.
Budovanie tehlovej steny je príkladom konečnej reakcie. Samotné tehly nie sú dostatočne kompaktné na to, aby vytvorili pevné telo. Je to preto, že neexistuje žiadny zisk energie, ktorý podporuje jeho spojenie (odráža sa aj v jeho možných nízkych intermolekulárnych interakciách).
Na vybudovanie steny potrebujete cement a prácu. Je to energia a ak je vnímaná energetická prínos (ekonomická, v prípade steny) je možná, ak sa vníma energetická prínos (ekonomická, v prípade steny).
Ak neexistujú žiadne výhody, stena sa zrúti pri akomkoľvek narušení a ich tehly nikdy nemôžu zostať zjednotené. To isté platí pre mnoho chemických zlúčenín, ktorých stavebné bloky sa nemôžu spontánne spojiť.
Charakteristiky konečnej reakcie
- Nie je to spontánne.
- Absorbovať teplo (alebo iný typ energie).
Dôvod je ten, že ich výrobky majú viac energie ako činidlá zapojené do reakcie. Vyššie uvedené môže byť reprezentované s nasledujúcou rovnicou:
ΔG = gProdukty-GČinidlá
Kde ΔG je zmena voľnej energie gibbs. Ako gProdukt je väčší (pretože je energickejší) ako gČinidlá, Odčítanie musí byť väčšie ako nula (AG> 0). Nasledujúci obrázok sumarizuje novo vysvetlené:
Môže vám slúžiť: síran sodný (NA2SO4): Štruktúra, vlastnosti, použitia, získanie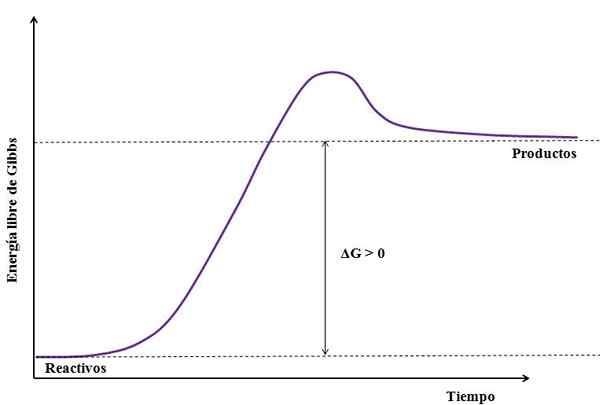 Obrázok endergickej reakcie. Zdroj: Gabriel Bolívar
Obrázok endergickej reakcie. Zdroj: Gabriel Bolívar Všimnite si rozdiel medzi energetickými stavmi medzi výrobkami a činidlami (Purple Line). Preto sa reagencie nepremenia na produkty (a+b => c), ak najprv nedošlo k absorpcii tepla.
Zvýšiť energiu voľnej energie
Každá endergonická reakcia má zvýšenie energie bez systému v systéme. Ak je pre určitú reakciu splnená, že ΔG> 0, potom nebude spontánne a bude vyžadovať vykonanie energie.
Ako matematicky poznať, či je reakcia engonická? Uplatňovanie nasledujúcej rovnice:
ΔG = AH-TAS
Kde AH je entalpia reakcie, to znamená, že celková uvoľnená alebo absorbovaná energia, AS je zmena entropie a teplota teploty. Faktor TAS je strata energie, ktorá sa nevyužila pri expanzii alebo objednávaní molekúl vo fáze (pevná látka, kvapalina alebo sóda).
A tak je energia, ktorú systém môže použiť na vykonávanie úlohy. Pretože AG má pozitívne znamenie pre konečnú reakciu, na získanie výrobkov sa musí použiť energia alebo práca (činidlá).
Takže poznanie hodnôt AH (pozitívne, pre endotermickú reakciu a negatívne pre exotermickú reakciu) a TAS, môžete vedieť, či je reakcia koncová -gononická.
To znamená, že aj keď je reakcia endotermická, Nie Je to nevyhnutne endogonické.
Kocka ľadu
Napríklad kocka ľadu topí v tekutine absorbujúcom teplotu, čo pomáha oddeliť svoje molekuly; Tento proces je však spontánny, a preto nejde o konečnú reakciu.
V prípade, že je ľad založený pri teplote výrazne pod -100 ° C, pojem T5 s voľnou energiou sa stáva malými v porovnaní s AH (pretože T klesá) a v dôsledku toho bude mať AG kladnú hodnotu kladnú hodnotu.
Môže vám slúžiť: karboxylová kyselinaInými slovami: Roztopte ľad pod -100 ° C je engonický proces a nie je spontánny. Podobným prípadom je zmraziť vodu okolo 50 ° C, čo sa nestane spontánne.
Odkazy ich výrobkov sú slabšie
Ďalšou dôležitou črtou, ktorá sa týka tiež AG, je energia nových väzieb. Spojenia vytvorených výrobkov sú slabšie ako odkazy na reagencie.
Zníženie sily prepojení je však kompenzované hmotnostným ziskom, ktorý sa odráža vo fyzických vlastnostiach.
Tu porovnanie s tehlovou stenou začína strácať zmysel. Podľa vyššie uvedeného musia byť tyče vo vnútri tehál silnejšie ako medzi nimi a cement. Stena ako celok je však rigidnejšia a odolnejšia voči väčšej hmotnosti.
Je spojený s exergonickými reakciami
Ak koncové reakcie nie sú spontánne, ako sa vyskytujú v prírode? Odpoveď je spôsobená spojením s inými reakciami, ktoré sú dosť spontánne (exergonické) a ktoré nejako podporujú ich vývoj.
Napríklad nasledujúca chemická rovnica predstavuje tento bod:
A + B => C (endergonická reakcia)
C + d => e (exergonická reakcia)
Prvá reakcia nie je spontánna, takže sa to prirodzene nemôže stať. Produkcia C však umožňuje druhú reakciu, ktorá spôsobuje a.
Pridanie Gibbs Free Energies pre tieto dve reakcie, AG1 a ΔG2, S výsledkom menším ako nula (ΔG<0), entonces el sistema presentará un incremento de la entropía y, por lo tanto, será espontáneo.
Môže vám slúžiť: hydroryKeby C nereagoval s D, nikdy by som ho nemohol vytvoriť, pretože nemám kompenzáciu energie (ako v prípade peňazí s tehlovou stenou). Potom sa hovorí, že C a D „Jalan“ na A a B reagovať, dokonca aj engonická reakcia.
Príklady endergonických reakcií
Fotosyntéza
Rastliny využívajú slnečnú energiu na vytváranie uhľohydrátov a kyslíka z oxidu uhličitého a vody. CO₂ a O2, Malé molekuly so silnými väzbami, forma cukrov, dechtových štruktúr, ktoré sú ťažšie, pevnejšie a topené pri teplote okolo 186 ° C.
Všimnite si, že odkazy C-C, C-H a C-O sú slabšie ako spojenia O = C = O a O = o. A z cukrovej jednotky môže rastlina syntetizovať polysacharidy, ako je celulóza.
Syntéza biomolekúl a makromolekúl
Endermanické reakcie sú súčasťou anabolických procesov. Rovnako ako uhľohydráty, aj iné biomolekuly, ako sú proteíny a lipidy, vyžadujú zložité mechanizmy, ktoré bez nich, a spojenie s hydrolytickou reakciou ATP, nemohli byť.
Tvorba diamantov a ťažkých zlúčenín suroviny
Diamanty vyžadujú obrovské tlaky a teploty, takže ich zložky môžu zhutňovať v kryštalickej tuhej látka.
Niektoré kryštalizácie sú však spontánne, aj keď prechádzajú veľmi pomalou rýchlosťou (spontánnosť nesúvisí s kinetikou reakcie).
Nakoniec, ropa samotná predstavuje produkt endergonických reakcií, najmä ťažkých uhľovodíkov alebo makromolekúl nazývaných asfaltény.
Ich štruktúry sú veľmi zložité a ich syntéza potrebuje veľa času (milióny rokov), teplo a bakteriálne pôsobenie.
Ďalšie príklady
- Bunkové dýchanie rastlín.
- Transport kyslíka v krvi.
- Difúzia iónov cez bunkové membrány.
- Svalová kontrakcia.
- Syntéza buniek.
Odkazy
- Endermanické a exeronické reakcie. Obnovené z Quimitube.com
- Energia. Zotavené z es.Khanacademy.orgán
- Definícia endergonickej reakcie. Zdroj z biológie.slepo

