Radikály si prenajímajú, ako sa tvoria, nomenklatúra, príklady

- 889
- 50
- JUDr. Rudolf Čapkovič
Ten Prenájom Sú to sada nestabilných molekúl, ktoré pochádzajú zo straty vodíkov alkánu. Vyznačujú sa tým, že zmiznú elektrón, takže rýchlo reagujú, aby dokončili oktet Valencie atómu, kde sa nachádza.
Tieto radikály sú symbolizované písmenom R, rovnako ako skupiny prenájmu, ale s rozdielom, že sa pridá bod, r ·. Tento bod naznačuje, že prítomnosť elektrónu zmizla. Napríklad zvážte plyn metánu, Cho4. Tento alkan, ktorý stratí jeden z jej vodíkov, sa transformuje na radikálne metyl, Cho3· (Obrázok nižšie).
 Všeobecný vzorec radikálneho alkylu a radikálneho metyl. Zdroj: Gabriel Bolívar cez Molview.
Všeobecný vzorec radikálneho alkylu a radikálneho metyl. Zdroj: Gabriel Bolívar cez Molview. Ak sa chcete prehĺbiť trochu o radikálnej štruktúre ch3·, Bude zrejmé, že jeho zmiznutý elektrón je v uhle kolmom na odkazy C-H; to znamená, že sa nachádza v orbitáli p čistý. Preto CHO3· Prijať hybridizáciu SP2, ako aj všeobecne s inými radikálmi alkyl.
Tieto radikály sú základným kameňom reťazových reakcií, na ktorých sa zúčastňujú alkány, ako je to v prípade ich halogenácií: chlorácie, bromácia atď. Existujú 1., 2. a 3. radikály, ako aj vinyl a alilic, každý s ich príslušnou stabilitou a ľahkosťou tréningu.
[TOC]
Ako sa tvoria radikály alkyl?
„Zjednodušená“ reakcia, pre ktorú sa tvoria radikály, je halogenácia alkánov. Na vytvorenie musí byť uvedená reťazová reakcia, ktorá sa vyskytuje iba pri vysokých teplotách (presahujúcich 250 ° C) alebo pod výskytom ultrafialového svetla pri teplote miestnosti.
Môže vám slúžiť: Sulfit sodný (Na2SO3)Zvážte chloráciu metánu za jednej z vyššie uvedených podmienok:
Cl2 → 2CL ·
Poskytnutá energia je dostatočná na prelomenie CL-Cl-Cl-CLOCK molekuly chlóru, ktorá sa vyskytuje homolitický zlom; To znamená, že každý atóm chlóru zostáva s jedným z elektrónov spojenia. Preto sa tvoria dva radikály.
Potom radikálny CL · útočí na molekulu metánu:
Cl · + ch4 → HCl + CH3·
A zdá sa, že radikálny metyl. Toto3· Je dosť nestabilný, takže okamžite reaguje, aby vyhral ďalší elektrón, s ktorým sa objaví jeho osamelý elektrón:
Chvály3· + CL2 → CH3CL + CL ·
Formovaný bude reagovať s inou molekulou metánu a cyklus sa bude opakovať znova a znova. Keď sa metán vyčerpá, dôjde k nasledujúcim reakciám, ktoré ukončia reťazovú reakciu:
CL · + · CL → CL2
Chvály3· + · Cho3 → CH3Chvály3
Chvály3· + · Cl → CH3Cl
Relatívna stabilita
Chvály3
Metán nie je jediný alkán, ktorý je „radikalizovaný“ chloráciou. Stáva sa to aj to isté s etánom, propánom, butánom a inými izomérmi. To, čo sa líši, je však potrebná energia, ktorá sa musí poskytnúť tak, aby radikály dehydrogovali molekulu alkánu. V prípade metylového radikálu je veľmi nestabilný, a preto je ťažké ich tvoriť.
Radikálny Cho teda3Chvály2· Je stabilnejšie a ľahšie sa vytvára ako Cho3·. Pretože? Pretože radikálny ch3Chvály2· Je to primárne, 1., čo znamená, že zmiznutý elektrón je na atóme uhlíka, ktorý je spojený s iným uhlíkom. Medzitým Cho3Akonáhle je spojená s atómami vodíka.
Môže vám slúžiť: fluorid: História, vlastnosti, štruktúra, získanie, riziká, použitieO čom to je? Pamätajte si na predchádzajúce zastúpenie, zmiznutý elektrón sa nachádza v orbitáli p, kolmo na ďalšie odkazy. V Ch3·, Atómy vodíka sotva darujú elektronickú hustotu atómu uhlíka v snahe kompenzovať nedostatok iného elektrónu.
1
V Ch3Chvály2· Na druhej strane uhlík so zmiznutým elektrónom je spojený s dvoma hydrogénmi a metylovou skupinou. V dôsledku toho tento uhlík dostáva väčšiu elektronickú hustotu, čo pomáha stabilizovať elektrón trochu zmizol. Rovnaké vysvetlenie platí pre ďalšie 1. alkynd radikály.
Druhý
V radikálnom sekundárnom alebo 2. alquil, ako je napríklad izopropilový radikál (ch3)2C. Preto je stabilnejší ako 1. a metylové radikály.
Tretí
Máme tiež terciárne alebo 3. alkyndové radikály, ako napríklad ter-butylová radikál3)3C ·. Sú stabilnejšie ako 1. a 2. Teraz sa existujú tri skupiny sýtené sýtené.
Alyl a vinyl
Za zmienku tiež stojí za to alylové radikály, Cho2= CH-CH2· A vinyl, cho2= Ch ·.
Alilic je najstabilnejší zo všetkých. Je to preto, že zmiznutý elektrón je dokonca schopný prejsť na atóm uhlíka druhého konca. Na druhej strane Vínilico je zo všetkých najstabilnejších zo všetkých, od skupiny Cho2=, viac kyseliny, priťahuje k sebe elektronickú hustotu namiesto toho, aby ju darovala na uhlík, keď zmizol elektrón.
Môže vám slúžiť: Hydroxid olovený: Štruktúra, vlastnosti, použitie, rizikáStručne povedané, relatívna stabilita alkyndových radikálov, od najvyšších po najnižšiu, sú:
Alilo> 3.> 2.> 1.> vinyl
Menovanie
Nomenklatúra radikálov alkyl je rovnaká ako v prípade nápravy. Tak, Cho3Chvály2· Sa nazýva etyl radikál; a radikálny ch3Chvály2Chvály2Chvály3, n-butyl.
Hlavné radikály prenájmy
Hlavné alkylové radikály sa zhodujú s alkylovými skupinami: sú to tie, ktoré majú menej ako šesť atómov uhlíka. Preto sú radikály odvodené od metánu, etánu, propánu, butánu a pentano. Podobne sú súčasťou tohto zoznamu radikálne vinyl a alilicos.
Ďalšími alkyndovými radikálmi, ktoré sa nachádzajú menej často, sú tie, ktoré odvodzujú z cykloalcanos, ako je cyklobután, cyklobután alebo cyklopentano.
Na nasledujúcom obrázku je niekoľko z týchto radikálov reprezentovaných priradenými písmenami:
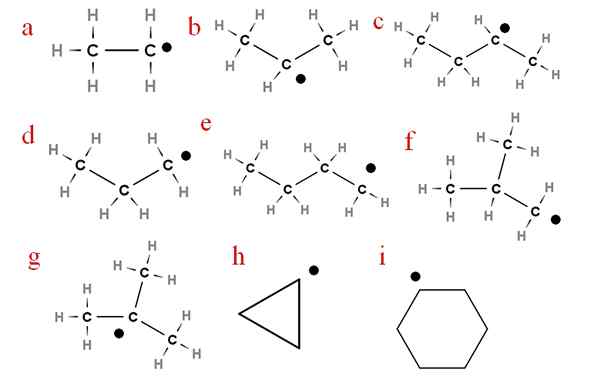 Deväť najdôležitejších radikálov alchery. Zdroj: Gabriel Bolívar.
Deväť najdôležitejších radikálov alchery. Zdroj: Gabriel Bolívar. Počnúc písmenom „A“ máme:
-A, etyl radikál
-B, izopropyl radikál
-C, secbutyl radikál
-D, radikálny propyl
-E, radikálne n-butyl
-F, izobutil radikál
-G, ter-butylové radikálne
-H, Radical Cycropilus
-I, radikálny cyklohexil
Každý z týchto radikálov môže alebo nemusí mať svoje vodíny nahradený inými skupinami, takže sa rovnako líšia ako alkány a ich štrukturálne izoméry.
Odkazy
- Morrison, r. Tón. a Boyd, R, N. (1987). Organická chémia. 5. vydanie. Redakčný Addison-Wesley Inter-American.
- Carey F. (2008). Organická chémia. (Šieste vydanie). MC Graw Hill.
- Graham Solomons t.W., Craig B. Fryhle. (2011). Organická chémia. (10. vydanie.). Wiley Plus.
- Wikipedia. (2020). Alkyl. Zdroj: In.Wikipedia.orgán
- Chémia librettexts. (5. júna 2019). Štruktúra alkylových radikálov: hyperconjugácia. Získané z: Chem.Librettexts.orgán
- « Koncepcia krížových referencií, funkcie, príklady
- Charakteristiky vodných zvierat, dýchanie, typy, príklady »

