Čo sú energetické podskupiny a ako sú zastúpené?
- 3573
- 1027
- MUDr. Žigmund Boška
Ten Energetické podskupiny V atóme sú spôsob, akým sú elektróny organizované v elektronických vrstvách, ich distribúcia v molekule alebo atóme. Tieto energetické čiastky sa nazývajú orbitály.
Organizácia elektrónov v čiastkových úrovniach je to, čo umožňuje chemické kombinácie rôznych atómov a tiež definuje jeho polohu v rámci periodickej tabuľky prvkov.

Elektróny sú usporiadané v elektronických vrstvách atómu určitým spôsobom kombináciou kvantových stavov. V tom čase je jeden z týchto štátov obsadený elektrónom, ostatné elektróny musia byť umiestnené v inom stave.
[TOC]
Zavedenie

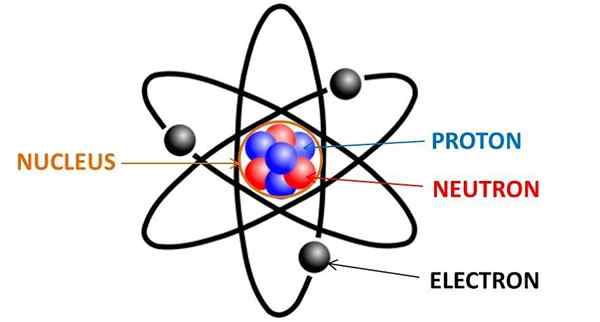
Každý chemický prvok v periodickej tabuľke pozostáva z atómov, ktoré sú zase zložené z neutrónov, protónov a elektrónov. Elektróny sú častice s negatívnym zaťažením, ktoré sú okolo jadra akéhokoľvek atómu, distribuované v orbitáli elektrónov.
Elektrónové orbitály sú objemom priestoru, v ktorom má elektrón 95% šancu byť. Existujú rôzne typy orbitálov s rôznymi spôsobmi. V každom orbitáli sa môže nachádzať maximálne dva elektróny. Prvý orbitál atómu je tam, kde existuje najväčšia pravdepodobnosť nájdenia elektrónov.
Orbitály sú označené písmenami S, P, D a F, to znamená ostrý, princíp, rozptýlený a základný a kombinovať sa, keď sú atómy spojené, aby sa vytvorila väčšia molekula. V každej vrstve atómu sú tieto kombinácie orbitálov.
Napríklad vo vrstve 1 atómu sú orbitály S, vo vrstve 2 sú orbitály S a P, v vrstve 3 atómu sú orbitály S, P a D a nakoniec vo vrstve 4 atómu sú všetky orbitály S, P, D a F.
Môže vám slúžiť: ad hoc: pôvod pojmu, významy a príklady použitiaTiež na orbitáloch nájdeme rôzne čiastkové úrovne, ktoré zase môžu ušetriť viac elektrónov. Orbitály na rôznych úrovniach energie sú navzájom podobné, ale zaberajú rôzne oblasti vo vesmíre.
Prvý orbitál a druhý orbitál majú rovnaké vlastnosti ako orbitálne uzly, majú pravdepodobnejšie sférické objem a dokážu udržať iba dva elektróny. Nachádzajú sa však na rôznych úrovniach energie, a tak zaberajú rôzne priestory okolo jadra.
Umiestnenie v periodickej tabuľke prvkov

Každá z elektronických konfigurácií prvkov je jedinečná, a preto určujú svoju pozíciu v periodickej tabuľke prvkov. Táto poloha je definovaná obdobím každého prvku a jeho atómovým číslom pre množstvo elektrónov, ktoré má prvok.
Použitie periodickej tabuľky na určenie konfigurácie elektrónov v atómoch je teda kľúčové. Prvky sú rozdelené do skupín podľa ich elektronických konfigurácií nasledovne:
Každý orbitál je znázornený v konkrétnych blokoch v periodickej tabuľke prvkov. Napríklad orbitálny blok S je oblasť alkalických kovov, prvá skupina v tabuľke a kde existuje šesť lítiových prvkov (Li), Rubidio (RB), draslík (k), sodný (NA), francio (FR) a Cesio (CS) a tiež vodík (H), ktorý nie je kov, ale plyn.
Táto skupina prvkov má elektrón, ktorý sa zvyčajne stráca na vytvorenie iónu s kladným zaťažením. Sú najaktívnejšie kovy a najreaktívnejšie.
Môže vám slúžiť: Opisná metódaVodík, v tomto prípade je to plyn, ale je v skupine 1 z periodických prvkov, pretože má tiež iba jeden elektrón. Vodík môže tvoriť ióny s jediným pozitívnym zaťažením, ale získanie jediného elektrónu vyžaduje oveľa viac energie ako na odstránenie elektrónov z ostatných alkalických kovov. Tvorovaním zlúčenín vodík zvyčajne vytvára kovalentné väzby.
Pri veľmi vysokých tlakoch sa však vodík stáva kovovým a správa sa ako ostatné prvky svojej skupiny. Vyskytuje sa napríklad vo vnútri jadra planéty Jupitera.
Skupina 2 zodpovedá alkalinoterróznym kovom, pretože ich oxidy majú alkalické vlastnosti. Medzi prvkami tejto skupiny nachádzame horčík (mg) a vápnik (CA). Jeho orbitály tiež patria do úrovne S.
Prechodné kovy, ktoré zodpovedajú skupinám od 3 do 12 v periodickej tabuľke, majú orbitály typu d.
Prvky od skupiny 13 až 18 v tabuľke zodpovedajú orbitálom P. A nakoniec prvky známe ako lantanidy a aktinidy majú orbitály s názvom f.
Poloha elektrónov na orbitáloch
Elektróny sa nachádzajú na orbitáloch atómov ako spôsob zníženia energie. Preto, ak sa snažia zvýšiť energiu, elektróny naplnia hlavné orbitálne hladiny a presunú sa od jadra atómu.
Treba sa uvažovať o tom, že elektróny majú vnútornú vlastnosť známu ako spin. Toto je kvantový koncept, ktorý okrem iného určuje, elektrón sa otočí v rámci orbitálu. Čo je nevyhnutné na určenie jej polohy v energetických čiastkových úrovniach.
Môže vám slúžiť: Metodologický dizajn: Štruktúra, ako to urobiť, príkladPravidlá, ktoré určujú polohu elektrónov na orbitáloch atómov, sú nasledujúce:
- Princíp AUFBAU: Elektróny vstupujú do orbitálov s menšou energiou. Tento princíp je založený na diagramoch energetických hladín určitých atómov.
- Princíp vylúčenia Pauli: Atómový orbitál môže opísať najmenej dva elektróny. To znamená, že iba dva elektróny s rôznymi elektrónovými rotáciou môžu zaberať atómový orbitál.
To znamená, že atómový orbitál je energetický stav.
- Sinn Rule: Keď elektróny zaberajú orbitály tej istej energie, elektróny vstúpia na prvé prázdne orbitály. To znamená, že elektróny uprednostňujú paralelné chrbtice v orbitáli oddelených od energetických čias.
Elektróny naplnia všetky orbitály v čiastkových úrovniach pred stretnutím protikladov.
Špeciálne elektronické nastavenia
Existujú aj atómy so špeciálnymi prípadmi energetických čiastkových stupňov. Keď dva elektróny zaberajú rovnaký orbitál, nemali by mať iba rôzne točenia (ako naznačuje princíp Pauliho vylúčenia), ale spojenie elektrónov mierne zvyšuje energiu.
V prípade energetických čiastkových stupňov, polovičná čiastková úroveň a plná, znížte energiu atómu. To vedie k atómu k väčšej stabilite.
Odkazy
- Konfigurácia elektrónov. Zotavené z Wikipédie.com.
- Elektronické konfurácie úvod. Chémia obnovená.Librettexts.orgán.
- Orbitály a dlhopisy. Chémia obnovená.Fsu.Edu.
- Pravidelná tabuľka, prvky hlavnej skupiny. Zotavené z novéhoWorldyclopedia.orgán.
- Princípy konfigurácie elektro. Zotavila sa.com.
- Elektronická konfigurácia prvkov. Zotavené z vedy.Uwaterloo.Ac.
- Elektrón. Zotavené z hyperfyziky.Fytrický.Gsu.Edu.

