Čo je chemická periodicita?
- 1478
- 169
- Adrián Fajnor
Ten Chemická periodicita Je to trend alebo vzorec, ktorý vykazuje chemické prvky pre súbor ich chemických a fyzikálnych vlastností. Stáva sa akýmsi príbuzenstvom, ktoré bolo základným sprievodcom pre rodičov chémie organizovať a klasifikovať všetky prvky v dnešnej známeho periodického tabuľky.
118 existujúcich prvkov (medzi prírodnými a umelými) sa udržiava v inej miere, vzťah so sebou, ktorý ich definuje v rodinách alebo skupinách. Spočiatku to umožnilo opísať reaktivity prvkov, ako aj typ zlúčenín, ktoré sa tvoria; A ešte lepšie, predpovedajte vlastnosti tých, ktorí ešte neboli objavení.
 Prvky periodickej tabuľky
Prvky periodickej tabuľky Potom, zatiaľ čo dvadsiate storočie a fyzika postupovali, tieto vlastnosti korelovali s elektronickou štruktúrou atómu. Elektróny teda označujú chemickú periodicitu v súvislosti s prvkami, ale nie toľko pre ich izotopy a relatívnu stabilitu.
Vďaka chemickej periodicite je možné pochopiť, prečo sú prvky umiestnené v rovnakej skupine v periodickej tabuľke. Umožňuje tiež predikciu chemických vlastností a dokonca aj fyzikálne medzi prvkami rôznych atómových hmôt.
[TOC]
Vzory a skupiny
 Rovnako ako kľukaté vzorce týchto oblakov, aj vlastnosti prvkov vykazujú periodickú a charakteristickú tendenciu. Zdroj: Pravin Bagga/CC By-S (https: // creativeCommons.Org/licencie/By-SA/3.0)
Rovnako ako kľukaté vzorce týchto oblakov, aj vlastnosti prvkov vykazujú periodickú a charakteristickú tendenciu. Zdroj: Pravin Bagga/CC By-S (https: // creativeCommons.Org/licencie/By-SA/3.0) Chemická periodicita sa pozoruje, ako sa očakávalo, v periodických vlastnostiach. Tieto sa vyznačujú tendenciou svojich hodnôt, pretože sa hodnotia počas periodického obdobia alebo skupiny.
Na účely porovnania je možné zvoliť kľukatý, pílu alebo strmú horu: s vzostupmi a pádmi. To znamená, že periodický rozsah vlastností má minimálne a maximálne pre určité prvky. A relatívne polohy týchto prvkov brilantne zodpovedajú umiestneniu v ich príslušných skupinách.
Preto je chemická periodicita užitočná na jej analýzu na základe skupín; Obdobia sú však nevyhnutné pre úplnú víziu trendu.
Môže vám slúžiť: uhličitan draselný (K2CO3): štruktúra, vlastnosti, použitia, získanieBude to vidieť s nasledujúcimi príkladmi periodicity v chémii, ktoré nielen zvyšujú periodické vlastnosti, ale aj v anorganických zlúčeninách a, inkluzívne, organické.
Ionizačná energia
Ionizačná energia, je, je jednou z najvýznamnejších periodických vlastností. Čím väčší je atóm prvku, tým ľahší z jeho posledných elektrónov bude odstránenie; to znamená, že vo Valencii. Preto: atómy s malými rádiámi budú mať veľké, zatiaľ čo atómy s veľkými rádiámi budú mať malé.
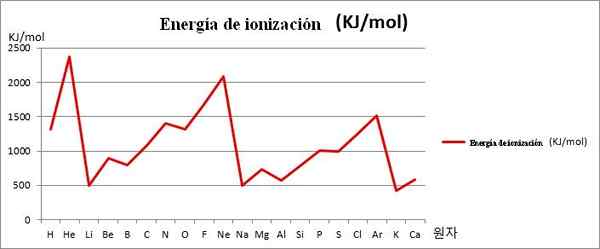 Ei vs. grafika. Prvých 20 chemických prvkov. Zdroj: Kenneth.J H.Han/CC By-SA (https: // creativeCommons.Org/licencie/By-SA/3.0)
Ei vs. grafika. Prvých 20 chemických prvkov. Zdroj: Kenneth.J H.Han/CC By-SA (https: // creativeCommons.Org/licencie/By-SA/3.0) Všimnite si napríklad na obrázku vyššie, že prvky Li, Na a K majú maloleté osoby EI, a preto sa nachádzajú v dolinách alebo fondoch grafiky. Medzitým sa prvky, ktoré, NE a AR, nachádzajú v samitoch alebo vyšších bodoch, pretože ich sú veľmi veľké vo vzťahu k ostatným prvkom.
Prvky Li, Na a K patria do skupiny alkalických kovov, ktoré sa vyznačujú ich obetiami EI. Na druhej strane, prvky, ktoré, NE a AR zodpovedajú ušľachtilým plynom, s veľmi vysokými, pretože ich atómy sú najmenšie medzi všetkými prvkami za rovnaké obdobie periodickej tabuľky.
Chemická periodicita teda naznačuje, že znižuje skupinu, ale zvyšuje cestovanie po dobu zľava doprava.
Blokovať hydros p
Príklad chemickej periodicity mimo periodických vlastností, ktoré vidíme v hydroroch blokových prvkov p.
Napríklad skupina 15 sa skladá z prvkov n, p, as, sb a bi. Ak je známe, že amoniak, NH3, Má dusík s oxidačným počtom +3, potom je možné podľa jednoduchej periodicity očakávať, že zostávajúce prvky majú podobné hydros. A skutočne to je: NH3, PH3, Popolček3, SBH3 a bih3.
Môže vám slúžiť: Bór: História, vlastnosti, štruktúra, použitieĎalší podobný prípad sa vyskytuje so skupinou 16. Kyslíkový hydrid je h2Alebo voda. Opäť sa očakáva, že prvky S, SE, TE a PO majú hydrory s rovnakými receptúrami, ale s priepastne odlišnými vlastnosťami. A to je: h2S, h2Se, h2Te a h2Po. Je to kvôli chemickej periodicite.
Snáď najpôsobivejší príklad chápe uhlík, kremík a germánium hydros. Hydrid uhlíka je Cho4, A to Silicon, Sih4. Germanio, ktoré predpovedal Mendeleev s menom Eka-silicio (ES), musí mať ako periodicitu hydrid s Gehovou receptúrou4; predpoveď, ktorá nakoniec potvrdila po jeho objavení a následných štúdiách.
Molekuly halogénu
Ak je známe, že fluorid je v elementárnom stave ako M molekula2, Potom sa predpokladá, že ostatné halogény (Cl, Br, I a AT) tiež tvoria diatomické molekuly. A to znamená byť molekulami CL2, Br2 a ja2 Najznámejší.
Oxidy a sulfidy
Podobne, ako je uvedené pri blokových hydroroch p, Oxidy a sulfidy pre prvky tej istej skupiny vykazujú druh korešpondencie v ich príslušných chemických vzorcoch. Napríklad oxid lítium je Li2Alebo oxidy pre iné alkalické kovy alebo skupina 1: NA2V poriadku2Alebo, RB2O a CS2Ani.
Je to tak preto, že vo všetkých z nich kovy s oxidačným počtom +1, interakcie s aniónom alebo2-. To isté sa deje s ich sulfidmi: li2S, na2S, atď. V prípade alkalinoterróznych kovov alebo skupiny 2 sú vzorce ich oxidov a sulfidov: včely a bes, mgo a MGS, CAO a CAS, SRO a SRS, Bao a BAS.
Môže vám slúžiť: kyselina selenary (H2SO3): Vlastnosti, riziká a použitiaTáto periodicita tiež uplatňuje (čiastočne) pre oxidy blokových prvkov p: Co2, SIO2, Geo2, B2Ani3, Do2Ani3, Utiecť2Ani3, atď. Avšak pre blokové prvky d alebo iné z bloku p, Táto periodicita sa stáva komplikovanejšou z dôvodu najvyšších možných oxidačných čísel pre rovnaký prvok.
Napríklad meď a striebro patria do skupiny 11. Jeden má dva oxidy: Cuo (Cu2+) a cu2Alebo (cu+); Zatiaľ čo druhý má sotva iba jeden: pred (AG+).
Uhľovodíky a silány
Uhlík aj kremík majú schopnosť tvoriť väzby C-C alebo Si-Si, v danom poradí. Väzby C-C sú oveľa stabilnejšie, takže uhľovodíkové štruktúry sa môžu stať neúmerne početnejšími a rôznymi ako štruktúry ich siltanových náprotivkov.
Tento záver je opäť vyplývajúci z chemickej periodicity. Napríklad etán, Cho3Chvály3 alebo c2H6 Disilanum má svoj náprotivok, Sih3Áno h3 alebo ak2H6.
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- HelMestine, Anne Marie, PH.D. (26. augusta 2020). Definícia periody v chémii. Zotavené z: Thoughtco.com
- A. Vložka. Babaev a Ray Hefferlin. (s.F.). Koncept chemickej periodicity:
Zo vzorov hyper-periodicity Mendeleev. Získané z: Chem.MSU.Ruka - Kvety P., Theopold k., & Langley R. (s.F.). Záver. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- Otvorená univerzita. (2020). Chemické vzorce sa nachádzajú v tabuľke periódy: Chemická periodicita. Získané z: Open.Edu

