Fyzikálne a chemické vlastnosti vody

- 2084
- 264
- Mgr. Pravoslav Mokroš
Ten Fyzikálne a chemické vlastnosti vody Sú to všetky tie prejavy vody, ktoré môžeme zmerať vďaka interakciám ich molekúl so sebou alebo so svojimi prostredím. Ale čo je voda? Voda je chemická látka alebo molekula, ktorá je tvorená spojením atómu kyslíka (O) s dvoma atómami vodíka (H).
Tieto tri atómy zostávajú zjednotené tvorbou kovalentných väzieb, veľmi silných a stabilných väzieb. Molekula vody je určená pre vzorec h2Alebo byť schopný písať ako H-O-H. Je to táto molekula, jej spojenia a jej interakcie sú zodpovedné za to, že sú bezfarebnou a bez chuti kvapalina bez chuti.

Voda je vo veľkom rozloženom podiele po celej Zemi, medzi čerstvou a slanou vodou. Voda je nevyhnutná pre život na našej planéte, pretože je to veľmi cenný prírodný zdroj. Je to medzi 60 a 70% v živých organizmoch, čo je vysoký pomer, ktorý im umožňuje plniť nespočetné množstvo funkcií.
Medzi niektoré z týchto životne dôležitých funkcií patria štrukturálne regulátory, ako je udržiavanie telesnej teploty a regulácia pH (kyslosť alebo alkalita) v rámci normálnych limitov. Podobne voda vykonáva prepravu živín a odpadu v živých bytostiach.
Používa sa tiež v mnohých oblastiach produktívnej, technologickej, vedeckej a každodennej rutinnej práce ľudskej bytosti; Z toalety, varenie jedla, okrem iného.
[TOC]
Fyzické vlastnosti vody
Fyzikálne vlastnosti vody súvisia s charakteristikami alebo veľkosťami, ktoré je možné merať alebo určiť pri zvažovaní hmoty, ako je jej hmota, energia,.
Medzi fyzické veľkosti vody patrí jej farba, vôňa, spôsoby, ako sa nachádza, a všetky tie, ktoré môžeme určiť bez reakcií alebo zmeniť jej chemické zloženie.
Ochutnať
Ochutnávaním nejakej čistej vody do nášho podnebia sa ukázalo, že je to insúr alebo bez chuti. Je to rovnako bez zápachu alebo vôňa. Pre proces čistenia je možné vnímať miernu vôňu, ktorá je spôsobená zvyškami chlóru. Sú to minerály, ktoré udeľujú vodu rôzne písmená príchutí.
Aspekt

Voda je všeobecne bezfarebná a priehľadná, keď sa pozoruje v sklenenom skle. Zdá sa však, že pri nahromadení vo veľkých množstvách vo veľkých nádobách alebo pri pozorovaní v ľadovcoch, riekach alebo moria.
Môže vám slúžiť: Aké sú zdroje výskumu?A v skutočnosti voda vykazuje určité bledo modrom sfarbenie, ktorého vnímanie je koncentrované, čím vyššie je množstvo vody.
Vodné štáty
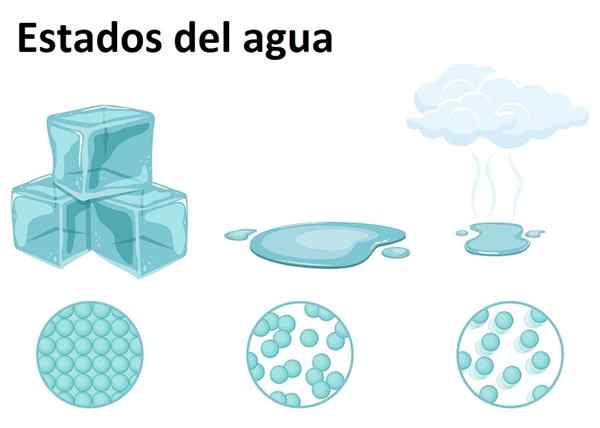 Pevné, tekuté a plynné stav
Pevné, tekuté a plynné stav Voda je na Zemi veľmi hojná a nájdete ju v ktoromkoľvek z troch stavov hmoty: pevná, tekutina alebo plynná. Voda pri teplote miestnosti je kvapalná látka, ktorá zodpovedá jej najbežnejšej forme.
Ako pevná látka sa voda nazýva ľad alebo sneh, v závislosti od veľkosti jej kryštálov a procesu jej tvorby. Medzitým sa plynný stav tvorí, keď voda prechádza z kvapalného stavu do plynného, tvoriace slávnu vodnú paru, ľahko rozpoznateľnú v kuchyni a nad jedlom.
Hustota
Hustota čistej vody sa pohybuje okolo 1 g/cm3. Medzitým je hustota morskej vody o niečo vyššia kvôli soli, ktorú obsahuje.
Bod mrazu
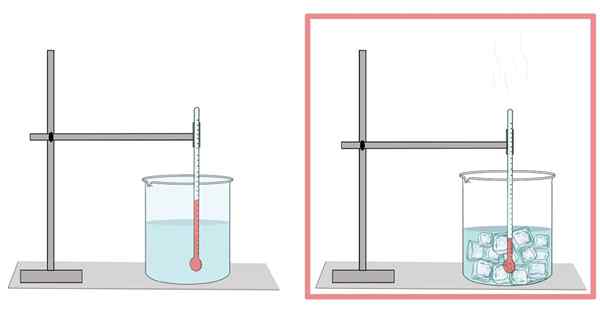
Voda zamrzne pri 0 ° C. Pri tejto teplote prechádza z jej kvapalnej fázy na tuhú látku. Keď je voda zamrznutá, rozširuje sa. Preto má vo svojej pevnej podobe menšiu hustotu ako vo svojom kvapalnom stave, čo uľahčuje plávanie ľadu na kvapalnej vode.
Podobne to je dôvod, prečo by sa chladenie vody vo fľaši nemalo veľa naplniť, pretože ľad sa rozširuje a končí prelomenie fľaše.
Bod varu
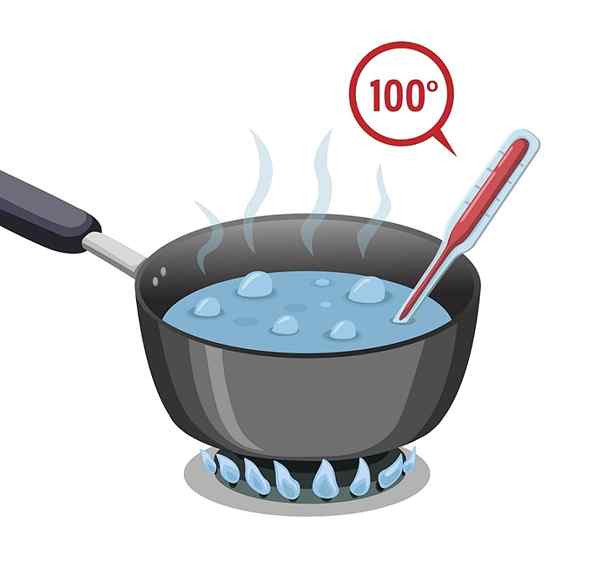
Voda má vysoký bod varu, ktorý je 100 ° C. Musí byť vystavený horúcemu, aby sa mohol zahriať a variť alebo dosiahnuť svoj bod varu.
Voda má potom vysoké špecifické teplo alebo tiež nazývanú tepelná kapacita, čo jej robí oneskorenie v zahrievaní; Ale tiež na ochladenie, to znamená, že proces potrebný na stratu získaného tepla je pomalý.
Táto vlastnosť ju robí veľmi užitočným v chladiacich systémoch, v systémoch regulácie telesnej teploty, okrem iného.
Elektrická vodivosť
Voda je dobrý vodič elektriny. Avšak čistá voda bude mať vždy určité množstvo iónov, čo mu dáva vlastnosť, že má jednu z najvyšších dielektrických konštánt medzi nemetalickými kvapalinami.
Súdržnosť
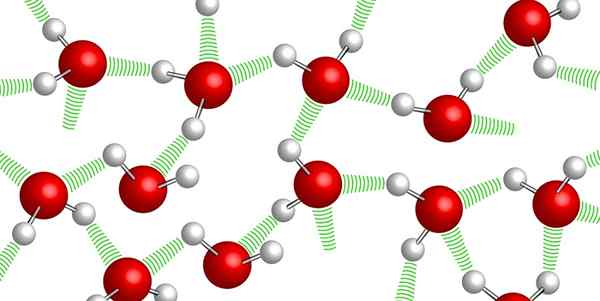 Vodíkové mosty medzi molekulami vody
Vodíkové mosty medzi molekulami vody Molekuly vody zostávajú navzájom vďaka So -zavolaným vodíkovým mostom: slabé väzby, ktoré sa stanovujú medzi jednou a druhou molekulou vody. Kvôli tejto vysokej úrovni súdržnosti je veľmi ťažké komprimovať vodu.
Môže vám slúžiť: 7 nástrojov dokumentárneho výskumuPrístup

Je ľahké, aby sa voda priľnala napríklad na dobre čistý povrch skla, ktorý tvorí film, ktorý nazývame vlhkosť alebo „mokra“. Voda sa tiež rýchlo dodržiava na našej pokožke, takže sa namočíme, len čo sa dostaneme do bazéna. Inak by sme za pár sekúnd sušili.
Povrchové napätie
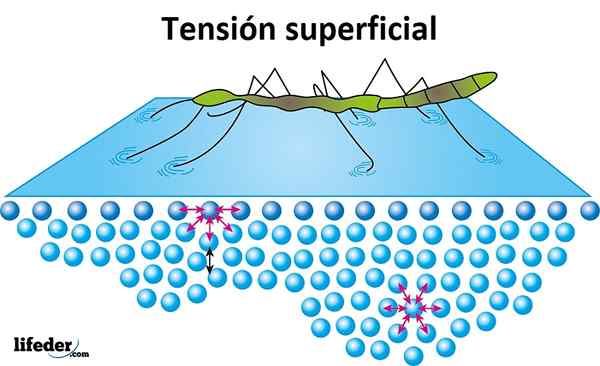
Povrchové napätie je odpor, ktorý ponúka kvapalina na jej povrchu, ktorá sa má preniknúť. Voda má vysoké povrchové napätie, produkt súdržnosti, ktorá existuje medzi jej molekulami, čo sa dá ľahko tvoriť, namiesto voľného šírenia hladkého povrchu.
Povrchové napätie sa dokazuje, keď sa zdá, že hmyz sa pohybuje alebo chodí po vode bez potopenia, a to je dôvod, prečo môžu niektoré listy alebo iné ľahké predmety vznášať sa nad vodou.
Kapitarita

Ľahkosť, s akou voda stúpa alebo nízka cez kapilárnu trubicu, opisuje vlastnosť kapilárnej vody vody. Táto vlastnosť je tiež spôsobená vysokými vlastnosťami súdržnosti a adhézie, ktorú má voda.
Kapilarita je využívaná povahou rastlín na dodávku vody do listov najvyšších vetiev stromu, ako aj uľahčuje jeho absorpciu koreňmi rastlín.
Podobne aj vlastnosti povrchového napätia a kapilarity robia z vody štrukturálnu časť buniek, ktorá je súčasťou krvi a ktorá ľahko preteká alebo preteká rôznymi krvnými cievami.
Akcia rozpúšťadla

Voda môže rozpustiť mnoho látok, ktoré sú životne dôležité pre živé organizmy, pretože všetky chemické reakcie živých bytostí sa vyskytujú vo vodnom prostredí. V živých organizmoch slúži ako transport živín, iónov a mnohých ďalších látok.
Slúži tiež na prepravu odpadu, ako je močovina, ktorá je eliminovaná močovou vodou. Keď sa látka rozpustí a dobre premieša s vodou, hovorí sa, že je hydrofilná alebo hydrosolubilná. Ak sa dobre nezmiešajte alebo sa nerozpustíte, hovorí sa, že látka je hydrofóbna alebo nerozpustná vo vode.
Chemické vlastnosti vody
Chemické vlastnosti alebo charakteristiky sú tie, ktoré sa vyskytujú, keď sa vyrábajú zmeny v chemickej štruktúre vody. Potom je dôležité sa stručne pozrieť na jeho molekulárnu štruktúru.
Chemická povaha
Voda je anorganická molekula, pretože neobsahuje C (uhlík) a jej chemický vzorec je H2Ani. Ich atómy sú spojené zdieľaním elektrónov tvoriacich kovalentné väzby, silné a veľmi stabilné väzby. Jeho molárna hmota je 18 g/mol, to znamená, že jeden krtek vody má hmotnosť 18 gramov.
Môže vám slúžiť: Vedecký výskumPolarita
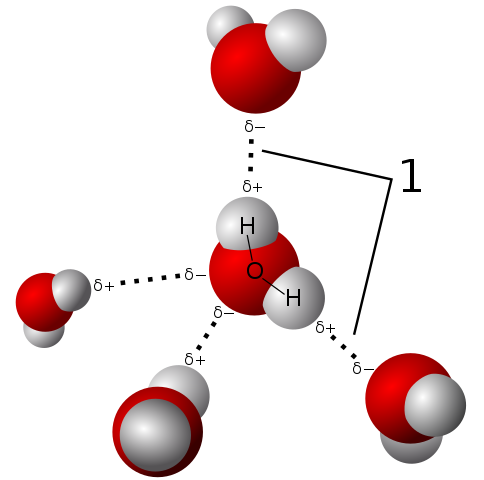 Polarita vody umožňuje jej molekule vytvoriť veľmi silné vodíkové mosty
Polarita vody umožňuje jej molekule vytvoriť veľmi silné vodíkové mosty Molekula vody je neutrálna, ale predstavuje určitú polaritu, pretože zdieľanie jej elektrónov nie je také spravodlivé.
Pretože kyslík priťahuje zdieľané elektróny silnejšie k sebe, molekula vody je s touto stranou, kde kyslík má tendenciu mať určité záporné zaťaženie; A preto zostáva s pozitívnym čiastočným zaťažením, kde sú vodíky (pozorujte vynikajúci obraz).
Táto polarita uľahčuje spojenie molekúl vody a vodného zväzku s inými molekulami, ktoré majú tiež rozdiely v zaťažení v ich štruktúre, čo podporuje fyzikálne vlastnosti opísané v predchádzajúcich oddieloch.
Ionizácia
Spontánne v kvapalnej vode je mierna ionizácia alebo sebaposkytovanie. To znamená, že niektoré z jeho molekúl sa reorganizujú zmenou normálnej molekulárnej štruktúry vytvárania nových elektricky zaťažených molekúl, ako sú napríklad hydrónske ióny (H3Ani+) a hydroxyl (OH-).
Reaktívna kapacita
Voda reaguje s mnohými látkami a vytvára veľkú rozmanitosť chemických zlúčenín. Elektrolýzou môže byť voda prerušená oddelením kyslíka od jeho dvoch hydrogénov. Tento proces sa vyskytuje, keď elektrický prúd prechádza vodou. Dokonca aj voda v jej tuhej podobe môže byť tiež súčasťou niektorých chemických reakcií.
pH
 PH takmer 7
PH takmer 7 Čistá voda má neutrálne pH (rovnajúce sa 7), zatiaľ čo morská voda je mierne alkalická (väčšia ako 7). Dažďová voda je okyslená (pH menej ako 7) mierne, keď sa zmieša s komponentmi nachádzajúcimi sa v atmosfére, ako je oxid uhličitý alebo CO2, Napríklad.
Anfoterizmus
Voda je amfotát, to znamená, že sa môže správať ako kyselina alebo ako základ v závislosti od pH roztoku. Táto chemická vlastnosť podporuje svoju úlohu regulátora pH.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Castillero m. Ani. (2020). Psychológia a myseľ. 15 fyzikálnych a chemických vlastností vody. Zotavené z: psychológie a.com
- Wikipedia (2020). Vlastnosti vody. Zdroj: In.Wikipedia.orgán
- Ostrý. Do. (s.F.). Voda: Štruktúra a vlastnosti. Získané z: Crystal.Prezerať.Výbuch.Edu
- Byju's. (s.F.). Fyzikálne a chemické vlastnosti vody. Získané z: Byjus.com
- Energia a životné prostredie školy. (s.F.). Voda bola zdrojom. Získané z: Eariscuola.slepo

