Sľúbená (PM) štruktúra, vlastnosti, získanie, použitie

- 4483
- 1036
- MUDr. Miloslav Habšuda
On sľúbený Je to chemický prvok, ktorý patrí do triedy Lantanids. Je identifikovaný so symbolom PM a jeho atómové číslo je 61. Je to rádioaktívna kovová tuhá látka a je najstabilnejším prvkom prvých 84 prvkov periodickej tabuľky.
Tento prvok sa prirodzene nachádza vo veľmi nízkych koncentráciách (asi 4 x 10-pätnásť Gramy na kg) v type uraninitu, čo je minerál uránu, v ktorom je sľubný prítomný v dôsledku spontánneho štiepenia uránu-238.
 Symbol, atómové číslo a atómová hmota sľubu. Zdroj: ME/CC By-S (https: // creativeCommons.Org/licencie/By-SA/2.5). Zdroj: Wikimedia Commons.
Symbol, atómové číslo a atómová hmota sľubu. Zdroj: ME/CC By-S (https: // creativeCommons.Org/licencie/By-SA/2.5). Zdroj: Wikimedia Commons. Napriek svojmu nedostatku v zemskej kôre bol detegovaný v spektre HR465 hviezdy konštelácie Andromeda, na ktorej povrch sa odhaduje, že sa nedávno formoval, pretože žiadny izotop PM nemá dlhší polovičný život 17, 17 7 rokov.
Bolo to užitočné v objektoch, ktoré žiaria v tme, ale kvôli ich rádioaktivite sa v nich prestalo používať. Používa sa na meranie hrúbky materiálu a batérie jadrovej energie.
[TOC]
Objavenie
Existenciu Prometio podozrilo v roku 1902 chemik Česk Bohuslav Brauner. Neskôr, v roku 1914, anglický fyzik Henry Moseley zistil vo svojich štúdiách, že medzi nodymiami a Samárom chýba prvok.
Následne, hoci niekoľko skupín vedcov (Talianov v roku 1924, Američania v rokoch 1926 a 1938) oznámilo svoj objav, ťažkosti s jeho oddelením od ostatných prvkov a reprodukcie zážitkov, ktoré sa nedokázali opodstatniť.
 Jacob a. Marinský. Doména Ornl / Pub. Zdroj: Wikimedia Commons.
Jacob a. Marinský. Doména Ornl / Pub. Zdroj: Wikimedia Commons. Nakoniec, v roku 1944 vedci Marinsky J.Do., Glendenin l.A. a Coryell C.D. Testovali svoju prítomnosť a izolovali ju z produktov štiepenia uránu v jadrovom reaktore Clintonových laboratórií v Oak Ridge v Tennessee v Spojených štátoch amerických.
 Larry E. Glendenin. Doména Ornl / Pub. Zdroj: Wikimedia Commons.
Larry E. Glendenin. Doména Ornl / Pub. Zdroj: Wikimedia Commons. Až do roku 1946 však netvrdili prioritu v objavovaní, pretože sa plne venovali tajným vyšetrovaniam týkajúcim sa obranných aktivít počas druhej svetovej vojny.
Priradenie názvu
Aj keď vedci navrhli, aby ho nazvali „Clintonium“ na počesť laboratórií, kde pracovali, Coryellova manželka ich presvedčila, aby ho nazvali „sľúbenými“ ako spomienkou na grécky Titan Prometheus alebo Prometheus.
 Charles D. Coryell. Autor fotografie: Christian a. Coryell/gfdl (http: // www.GNU.Org/copyleft/fdl.html). Zdroj: Wikimedia Commons.
Charles D. Coryell. Autor fotografie: Christian a. Coryell/gfdl (http: // www.GNU.Org/copyleft/fdl.html). Zdroj: Wikimedia Commons. Podľa niektorých interpretácií gréckej mytológie Prometheus ukradol oheň bohov, aby ho dal ľudstvu, takže bol kruto potrestaný za celú večnosť. Ďalšie legendy hovoria, že poskytovali ľudským bytostiam matematiku, vedu, poľnohospodárstvo a medicínu a dokonca vytvorili človeka.
Môže vám slúžiť: Clausius-Clapeyronova rovnica: Na čo ide, príklady, cvičenia Prometheus zastúpenie nemeckého sochára. © el Grafo / CC-BY-SA-4.0 / Pub Doména. Zdroj: Wikimedia Commons.
Prometheus zastúpenie nemeckého sochára. © el Grafo / CC-BY-SA-4.0 / Pub Doména. Zdroj: Wikimedia Commons. Tieto pochybnosti o tom, čo bolo Prometheusovým prínosom k ľudskosti, pripomína neistotu o tom, kto objavil prvok. Na druhej strane, podľa Coryellovej manželky, bolo meno opodstatnené, pretože vedci „ukradli oheň bohov“, keď ho objavili počas programu Atomic Bomb Secret Program.
Elektronická štruktúra
Elektronická konfigurácia tohto prvku je:
1siež2; 2siež2 2p6; 3siež2 3p6 3d10; 4siež2 4p6 4d10; 5siež2 5p6; 4F5 6siež2;
ktoré možno tiež vyjadriť ako:
[Xe] 4F5 6siež2.
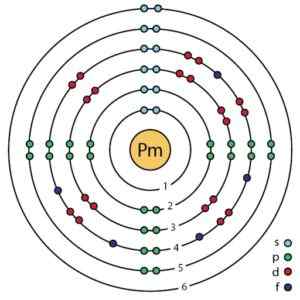 Prometio Electronic Structure Podľa zlepšeného atómového modelu Bohra. Breh.ScienceWriter/CC BY-SA (https: // creativecommons.Org/licencie/By-SA/4.0). Zdroj: Wikimedia Commons.
Prometio Electronic Structure Podľa zlepšeného atómového modelu Bohra. Breh.ScienceWriter/CC BY-SA (https: // creativecommons.Org/licencie/By-SA/4.0). Zdroj: Wikimedia Commons. Menovanie
- Sľúbené, symbol PM.
- Prometio-147, PM-147 alebo 147PM: Izotop del Prometio s atómovou hmotnosťou 147.
Vlastnosti prométiu
Fyzický stav
Naplnené kovové tuhé, šesťuholníkové kryštály.
Atómová hmota
144,91
Bod topenia
1042 ° C
Bod varu
3000 ° C
Hustota
7,26 g/cm3
Chemické vlastnosti
Patrí do rodiny Lantanidov, latanoidov alebo „vzácnych zemín“, nazývaných tak, pretože v zemskej kôre sú vždy vo forme ich oxidov. Sú súčasťou obdobia 6 periodickej tabuľky prvkov.
Podľa konzultovaných zdrojov reaguje PM, rovnako ako ostatné lantanidy, priamo s vodou, pomaly chladný, rýchlo pri zahrievaní a uvoľňovaní vodíka (H2). Vo vzduchu rýchlo stmavne a horí ľahko produkovať svoj oxid.
Bolo pripravených viac ako 30 zlúčenín prométio a najviac predstavuje určitý druh sfarbenia. Jeho oxidačný stav v týchto zlúčeninách je +3. Netvorí tetravalentné katióny.
Tvorba niektorých zlúčenín
Zrušenie ho v kyseline chlorovodíkovej (HCI) sľúbené tvorí PMCL3 čo je žlté a vo vode rozpustné. V kyseline dusičnej (HNO3) PM sa generuje (nie3)3 To je ružové a tiež rozpustné vo vode.
Ak roztok obsahujúci PM ióny3+ je alkalizovaný NH3, To znamená, že pH sa zvyšuje, zráža sa hydroxid (PM (OH)3) svetlo hnedá.
Môže vám slúžiť: iónový odkaz: Charakteristiky, ako sa formuje a príkladySulfát PM2(SW4)3 Je mierne rozpustný vo vode. Ak sa oxalát Prometio zahreje, stane sa oxidom PM2Ani3 biela alebo levanduľa.
Rádioaktívne emisie
Emituje beta žiarenie vo forme elektrónov, ktoré opúšťajú jadro ich atómov. Pri jeho vydávaní sa stáva prvkom Samarium (SM). Na druhej strane sa môže stať neodymiam (ND) odstránením jadrového pozitrónu a zachytením elektrónu v rovnakom. PM nevydáva gama lúče.
Izotopy
Doteraz je známych 14 izotopov Prometio s atómovými hmotami, ktoré sa pohybujú od 134 do 155. Všetky sú nestabilné (rádioaktívne), čo ho odlišuje od iných lantanidov.
Prometio-147 je ten, ktorý má najväčšiu užitočnosť a má polčas 2,6 roka.
Izotop s väčším polovičným životom
Najdlhší izotop polovičného života je Prometio-145 so 17,7 rokmi, ktorý sa rozpadá elektronickým zachytením, ktorý pozostáva z atómového elektrónu, je kombinovaný s protónom a tvorí neutrón a neutríno.
Je to však jediný izotop PM, ktorý môže tiež trpieť dezintegráciou alfa (emisie 2 neutrónov). Je to preto, že má 84 neutrónov a vydanie 2 z nich robí prométio-141 s 82 neutrónmi, čo je stabilná konfigurácia jadra. Ale toto je typ rozpadu, ktorý sa vyskytuje veľmi málo.
Získanie prúdu
V roku 1963 sa približne 10 gramov prométio pripravilo pomocou metód chromatografie iónov v palivovom odpade z atómového reaktora. Dnes sa týmto spôsobom stále zotavuje ako soli 147Popoludnie3+.
Podľa určitých zdrojov bol v týchto rokoch pripravený aj znížením fluoridu (PMF3) S lítiovou parou (Li). Pripravuje sa tiež redukciou chloridu (PMCL3) S vápnikom (CA) pri vysokých teplotách.
Môže sa tiež získať z Neodymium-146. Tento izotop je vystavený bombardovaniu neutrónmi, takže každý atóm zachytáva neutrón a stáva sa noodymia-147. Ten trvá asi 11 dní utrpenie beta dezintegrácie, a tak sa transformuje v promérii-147.
Žiadosti
Izotop 147 (147PM) je ten, ktorý sa používa najviac, a je jediný, ktorý sa dá nájsť komerčne. Nemituje gama lúče a dodáva sa vo forme oxidu alebo chloridu. Ich transport a manipulácia si však vyžadujú ochranu pred žiarením.
Môže vám slúžiť: Hydrolýza: Čo je to a príklady reakciíMal niektoré použitia, ktoré dnes už nemá, pretože sa v súčasnosti používa v špeciálnych aplikáciách.
V batériách
Prometio-147 sa používa v dlhodobých atómových batériách. V tomto prípade sú malé kúsky PM umiestnené v matrici polovodiča na premenu emisií beta na elektrinu.
Tento typ batérií jadrovej energie môže poskytovať energiu asi 5 rokov a používať sa vo všetkých typoch zariadení, od rakiet po kardiostimulátory, ktoré sú zariadeniami umiestnenými u pacientov so srdcovými problémami.
 Kardiostimulátory môžu mať dlhé -lastvové batérie založené na Prometio. Autor: 242799. Zdroj: Pixabay.
Kardiostimulátory môžu mať dlhé -lastvové batérie založené na Prometio. Autor: 242799. Zdroj: Pixabay. V lekárskych aplikáciách
Podľa určitých zdrojov sa oxid Prometio používa v medicíne ako zdroj žiarenia.
V priemysle
Používa sa na meranie hrúbky niektorých materiálov, ktoré sa vykonáva meraním beta žiarenia, ktoré prechádza vzorkami.
Potenciálne aplikácie
Mohlo by sa použiť ako prenosný zdroj X -Bay, ale táto aplikácia zjavne ešte nebola komerčne vyvinutá.
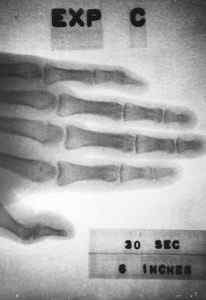 Röntgenový obraz získaný v roku 1963 s malým zariadením (približne 10 cm x 5 cm x 1 cm) obsahujúcich prometio-147. Energia.Doména vlády / krčmy. Zdroj: Wikimedia Commons.
Röntgenový obraz získaný v roku 1963 s malým zariadením (približne 10 cm x 5 cm x 1 cm) obsahujúcich prometio-147. Energia.Doména vlády / krčmy. Zdroj: Wikimedia Commons. Slúžilo by to tiež na zabezpečenie energie do vesmíru a satelitných sond alebo na výrobu zariadení, ktoré umožňujú komunikáciu s ponorkami.
Prerušené použitie v ľahkých signáloch
Spočiatku sa Prometio-147 použil na nahradenie rádiového prvku v svetelných číselníkoch, pretože sa dozvedelo, že rádio je príliš nebezpečné. Z tohto3 S luminofórmi, ktoré svietia zo zelenkavej žltej na modrú, keď na ne ovplyvňuje žiarenie sľúbených (beta častíc).
 Niektoré pred desiatkami rokov boli ihly hodiniek náramkov viditeľné v tme kvôli jasu spôsobeného rádioaktivitou Prometio. Autor: Monacocannes. Zdroj: Pixabay.
Niektoré pred desiatkami rokov boli ihly hodiniek náramkov viditeľné v tme kvôli jasu spôsobeného rádioaktivitou Prometio. Autor: Monacocannes. Zdroj: Pixabay. Táto vlastnosť bola použitá v hodinkách náramkov alebo vytáčania, aby žiarila v tme. Tiež v tlačidle zapaľovania niektorých žiarivkových žiaroviek. Okrem toho nepoškodil luminofóry, ako je to v prípade iných zdrojov ožarovania beta, čím sa rozšírila životnosť zariadení.
Keď sa však zistilo, že sľubné je tiež nebezpečné, jeho použitie na trhu objektov, ktoré žiaria v tme.
Riziká
PM je rádioaktívny prvok, takže sa musí manipulovať s mimoriadnou opatrnosťou a náležitou ochranou. Okrem beta častíc, ktoré emituje, môžu ovplyvniť prvky s hlavným atómovým číslom a generovať X -Rays.
 Prometio vzorky sa musia prepravovať v hrubom štíte oloveného, aby sa predišlo škodlivým účinkom žiarenia, ktoré vydávajú. Energia.Doména vlády / krčmy. Zdroj: Wikimedia Commons.
Prometio vzorky sa musia prepravovať v hrubom štíte oloveného, aby sa predišlo škodlivým účinkom žiarenia, ktoré vydávajú. Energia.Doména vlády / krčmy. Zdroj: Wikimedia Commons. Odkazy
- Alebo.Siež. Lekárska knižnica. (2019). Promethium - PM (prvok). Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Ganjali, m.R. a kol. (2016). Úvod do série lantanidu (od Lanthanum po lotetium). Promethia. V lantanidových sériách Stanovenie rôznymi analytickými metódami. Zotavené z vedeckých pracovníkov.com.
- Osekávanie. a kol. (2013). Pôvod vesmíru a nukleosyntézy. Pomalé zachytenie neutrónov. V rádiochémii a jadrovej chémii (štvrté vydanie). Zotavené z vedeckých pracovníkov.com.
- Olovo, D.R. (Editor) (2003). Príručka chémie a fyziky CRC. 85th CRC Press.
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.
- Kráľovská spoločnosť chémie. (2020). Promethia. RSC obnovil.orgán.

