Typy adiabatických procesov, príklady, vyriešené cvičenia
- 4549
- 96
- Ing. Ervín Petruška
A Adiabatický proces Je to ten, kde medzi systémom a jeho okolím nie je výmena tepla, buď preto, že sa vyskytuje v izolačnom médiu, alebo preto, že prechádza veľmi rýchlo. To znamená, že v okolí systému by sa to týkalo študovanej časti vesmíru, nemali by sa vnímať zmeny teploty, ale iba fungujú iba.
Toto je jeden z elementárnych procesov termodynamiky. Na rozdiel od ostatných procesov (izokorických, izobarických a izotermálnych), žiadna z jej fyzických premenných nezostáva konštantná; To znamená, že sa mení veľkosť tlaku, objemu, teploty a entropie, ako sa vyvíja adiabatický proces.
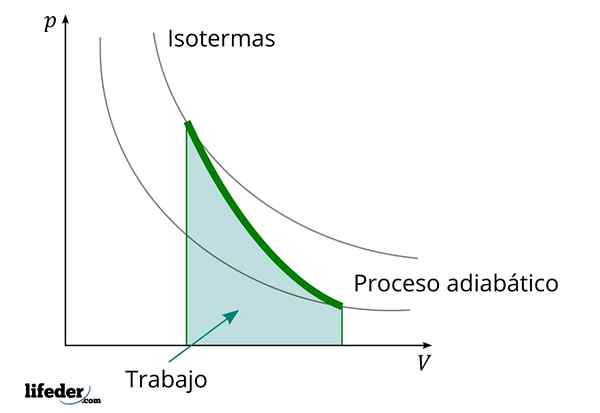
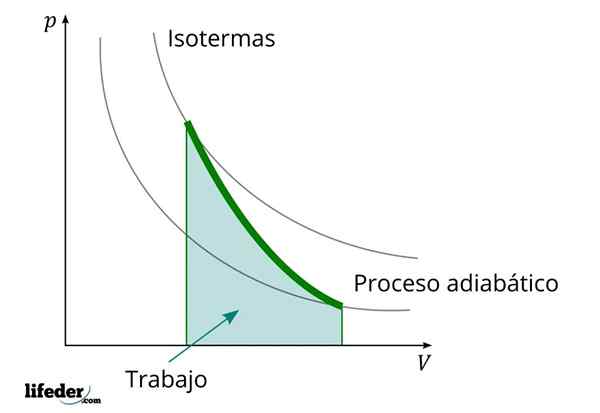 Počas adiabatického procesu, v ktorom sa objem zvyšuje, vnútorná energia látky, ktorú práca klesá
Počas adiabatického procesu, v ktorom sa objem zvyšuje, vnútorná energia látky, ktorú práca klesá Ďalšou dôležitou charakteristikou adiabatických procesov je to, že vykonávajú alebo konzumujú prácu úmerne k zmene vnútornej energie ich systémov; V tomto prípade z tých, ktoré majú molekuly v plynnej fáze. Toto sa dá preukázať vďaka prvému zákonu termodynamiky.
V každodennom živote tento typ procesu pokrýva predovšetkým geofyzikálne javy a do istej miery fungovanie piestov v dieselových motoroch. Prenosu tepla sa často bráni pri použití izolačného média, ale práve rýchlosť týchto procesov umožňuje ich skutočný vývoj.
[TOC]
Reverzibilné a nezvratné adiabatické procesy
Zvrátený
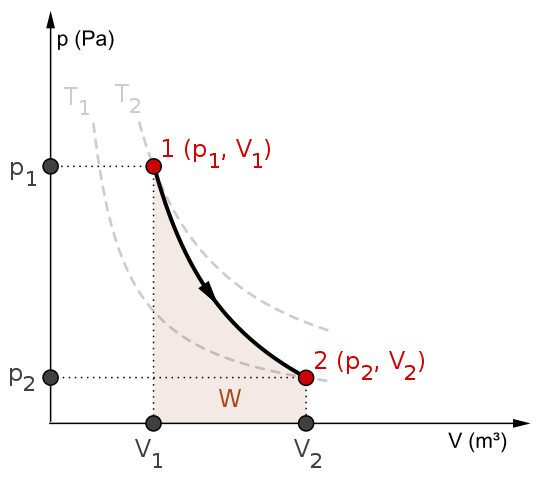 P-V diagram a práca w pre adiabatický proces. Zdroj: Mikerun/CC By-SA (https: // creativeCommons.Org/licencie/By-SA/4.0)
P-V diagram a práca w pre adiabatický proces. Zdroj: Mikerun/CC By-SA (https: // creativeCommons.Org/licencie/By-SA/4.0) Adiabatické procesy môžu byť reverzibilné alebo nezvratné. Prvý však existuje iba ako teoretické nástroje na štúdium druhého. Reverzibilné adiabatické procesy teda zahŕňajú ideálne plyny a chýbajú trenie a akúkoľvek inú možnosť, ktorá spôsobuje prenos tepla medzi systémom a jeho okolím.
Zoberme si napríklad diagram P-V pre reverzibilný adiabatický proces zhora. Tón1 a t2 zodpovedajú dvom izotermom, na ktoré tlaky P a zväzky Vložka systému sa líši.
Medzi štátmi (str1, Vložka1) A p2, Vložka2) Vykonáva sa reverzibilná adiabatická expanzia, pretože sa presúvame z objemu V1 do jedného v2, väčšie, smerom k smeru šípky.
Systém sa tým ochladí, ale bez poslúchania správania izotermov. Oblasť pod krivkou zodpovedá práci W, ktorej hodnota je pozitívna, pretože ide o expanziu.
V tomto procese zostáva entropia konštantná, a preto sa hovorí, že je izontropický. Matematické spracovanie tejto reverzibility generuje súbor rovníc, s ktorými je možné vyhodnotiť iné systémy.
Môže vám slúžiť: elektrolytické bunkyNezvratný
Nevratné adiabatické procesy, na rozdiel od reverzibilných, nie sú grafické v diagramoch P-V s kontinuálnymi, ale bodkovanými čiarami, pretože iba konečné a počiatočné stavy majú dobre definované premenné (P, V a T). Tieto procesy zahŕňajú skutočné plyny, takže rovnica ideálnych plynov a ich derivácie sa na ne priamo nevzťahujú.
Rýchlo prechádzajú a bránia prenosu tepla medzi systémom a jeho okolím. Tiež sa v nich zvyšuje entropia, ako je uvedené v druhom zákone termodynamiky.
Príklady adiabatických procesov
 Izolačná kapacita, ako je kapacita prezentovaná termosom, je jedným z kľúčových faktorov procesu vývoja adiabaticky
Izolačná kapacita, ako je kapacita prezentovaná termosom, je jedným z kľúčových faktorov procesu vývoja adiabaticky Niektoré príklady adiabatických procesov budú uvedené nižšie.
Rozšírenie a porozumenie
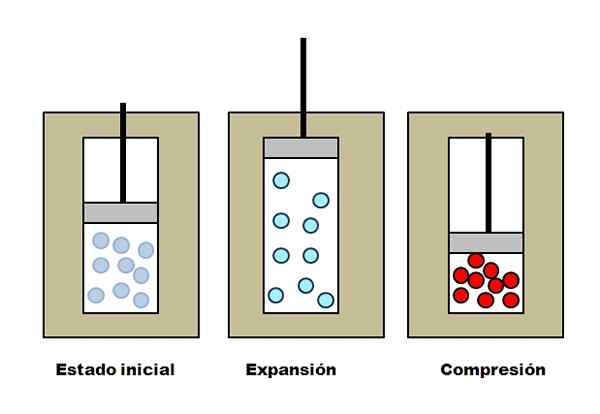 Adiabatické rozšírenie a porozumenie. Zdroj: Gabriel Bolívar.
Adiabatické rozšírenie a porozumenie. Zdroj: Gabriel Bolívar. Predpokladajme, že tri izolačné vesty obsahujúce priehradky plné plynu. V počiatočnom stave nemá piest na plyn žiadny tlak. Potom sa piest nechá stúpať, čo zvyšuje objem, prostredníctvom ktorého sa môžu molekuly plynu pohybovať, čo spôsobuje zníženie vnútornej energie; A preto zníženie teploty.
Opak sa stane pri adiabatickej kompresii: Piest vykonáva prácu na plyne, čím sa znižuje objem, ktorý môžu jeho molekuly obsadiť. Vnútorná energia sa tento čas zvyšuje, čo tiež znamená zvýšenie teploty, ktorej teplo sa nemôže rozptýliť smerom k okolia kvôli izolačnej veste.
Výstup magmy
Kanály, kde magma stúpa vo vnútri sopky, hovoria ako izolačné médium, ktoré zabraňuje prenosu tepla medzi magmou a atmosférou.
Zvukový roztiahnutie
Plyny sú narušené a rozširované podľa zvukovej vlny bez chladenia alebo horúceho vzduchu, ktorý ich obklopuje.
Účinok
Foehn Effect je príkladom adiabatických procesov v oblasti geofyziky. Vzduchové masy stúpajú smerom k hornej časti hory, kde zažívajú menší tlak, takže ich molekuly sa rozširujú a chladia, čo vedie k vzniku tvorby mraku.
Sotva zostupujú na druhej strane hory, tlak sa zvyšuje, a preto sú molekuly stlačené a zvyšujú ich teplotu, čo spôsobuje zmiznutie mraku, čo spôsobuje zmiznutie oblaku.
Môže vám slúžiť: chlórbenzén (C6H5Cl)V nasledujúcom videu je možné oceniť tento jav:
Vyriešené cvičenia
Nakoniec sa vyrieši niekoľko cvičení. Je dôležité mať k dispozícii nasledujúce rovnice:
ΔU = Q - W (prvý zákon termodynamiky)
Ale bez prenosu tepla, q = 0 y:
ΔU = - W (1)
To je: ak je práca W pozitívna, ΔU je negatívna a naopak. Na druhej strane máme tiež:
W = -nCVložkaΔT (2)
Že po použití ideálnej rovnice plynov (PV = nRt) a nahradenie a riešenie pre t2 a t1 budeme mať:
W = (cVložka/R) (P1Vložka1 - P2Vložka2) (3)
Je hodnota R rovná sa 0.082 l · atm/mol · k alebo 8.314 j/mol · k
V adiabatických procesoch je dôležité poznať vzťah CP/CVložka Známy ako γ:
γ = cP/CVložka (4)
Čo umožňuje nadviazať vzťahy T-V a P-V:
Tón1Vložka1γ-1 = T2Vložka2γ-1 (5)
P1Vložka1γ = P2Vložka2γ (6)
A tiež približné teploty CP a cVložka Líšia sa v závislosti od toho, či sú plyny monoatomické, diatomické atď.
Cvičenie 1
Plyn vykonáva 600 j práce prostredníctvom izolovaného priehradky. Aká je zmena vo svojej vnútornej energii? Znižuje alebo sa zvyšuje teplota? A vzhľadom na to, že ide o monooktomický plyn, tiež vypočítajte γ.
Údaje:
W = +600J
ΔU = ¿?
γ =?
W práca je pozitívna, pretože plyn pracuje na okolí. Byť vo vnútri izolovanej priehradky, q = 0, a preto budeme mať rovnicu (1):
ΔU = - W
To znamená, ΔU sa rovná:
ΔU = - (+600J)
= -600J
Čo znamená, že vnútorná energia plynu klesla 600 j. Ak Au klesá, tak sa teplota stáva, takže plyn ochladzuje v dôsledku vykonania práce.
Pretože tento plyn je monoatomický,
CVložka = 3/2 r
CP = 5/2 r
A bytosť
γ = cP/CVložka
= (5/2 r)/(3/2 r)
= 5/3 alebo 1.66
Cvičenie 2
V nádobe 7 mólov O2 Boli komprimované z objemu 15 litrov do 9 litrov. Vedieť, že počiatočná teplota bola 300 K, vypočítajte: práca vykonaná na plyne.
Údaje:
n = 7 mólov alebo2
Tón1 = 300 K
Vložka1 = 15 l
Vložka2 = 9 l
W = ¿?
Je to nezvratné adiabatické porozumenie. Máme dve rovnice na vyriešenie W:
W = -nCVložkaΔT (2)
W = (cVložka/R) (P1Vložka1 - P2Vložka2) (3)
Tlaky ich môžu vypočítať, ale aby sa ušetril čas, je lepšie pokračovať v prvých rovniciach:
Môže vám slúžiť: destilovaná vodaW = -nCVložkaΔt
= -nCVložka (T2-Tón1)
Potrebujeme cVložka a t2 Určiť w. Kyslík, ktorý je diatomickým plynom, má cVložka rovná sa 5/2 R:
CVložka (Buď2) = 5/2 r
= 5/2 (8.314 J/mol · k)
= 20.785 j/mol · k
Musíme vypočítať t2. Obrátime sa na rovnicu (5):
Tón1Vložka1γ-1 = T2Vložka2γ-1
Ale pred použitím musíte určiť ako prvé cP a γ:
CP (Buď2) = 7/2 r
= 7/2 (8.314 J/mol · k)
= 29.099 j/mol · k
Byť γ rovná sa:
γ = cP/CVložka
= (29.099 j / mol · k) / 20.785 j/mol · k
= 1.4
Takže to môžeme vyčistiť2 Z rovnice (5):
Tón1Vložka1γ-1 = T2Vložka2γ-1
Tón2 = (T1Vložka1γ-1) / (V2γ-1)
= [(300 k) (15l)1.4-1] / (9l)1.4-1
= 368.01 K
A nakoniec vyriešime pre W:
W = -nCVložkaΔt
= -(7 mol o2) (dvadsať.785 j/mol · k) (368.01 K - 300 K)
= -9895.11 j o -9.895 kj
Cvičenie 3
Neónový nádoba sa rozširuje adiabatický a spočiatku pri teplote miestnosti (t = 298k) od 12 do 14 l. Vedieť, že jeho počiatočný tlak bol 3 bankomat, aká bude práca vykonaná plynom?
Údaje:
Tón1 = 298 K
Vložka1 = 12 l
Vložka2 = 14 l
P1 = 3 bankomat
W = ¿?
Rovnica (3) nám umožňuje určiť w s hodnotami tlakov:
W = (cVložka/R) (P1Vložka1 - P2Vložka2)
Ale chýba nám cVložka A p2.
Konečný tlak sa dá vypočítať pomocou rovnice (6):
P1Vložka1γ = P2Vložka2γ
Byť γ rovná sa CP/CVložka. Pretože neón je monoatomický plyn, máme svoje hodnoty CP a cVložka Sú 5/2R a 3/2R, respektíve. Vypočítame potom γ:
γ = cP/CVložka
= (5/2R)/(3/2R)
= 5/3 alebo 1.66
Vyčistíme P2 Z rovnice (6):
P2 = (P1Vložka1γ) / V2γ
= [(3 atm) (12 l)5/3] / (14 l)5/3
= 1.40 bankomat
A práca sa bude rovnať:
W = (cVložka/R) (P1Vložka1 - P2Vložka2)
= (3/2) [(3 atm) (12 l) - (1.40 atm) (14 l)] (101300 pa/1 atm) (0.001 m3/L) (KJ/1000 J)
= 2.49 kj
Konverzné faktory sa používajú na prevod L · atm a pa · m3, čo zodpovedá 1 j. Neónový plyn sa rozširuje, takže jeho tlak klesá a pri práci v okolí je to pozitívne. Tiež jeho vnútorná energia AU klesá, ako aj jej teplota, ochladenie v procese expanzie.
Odkazy
- Walter J. Moore. (1963). Fyzikálna chémia. V chemickej kinetike. Štvrté vydanie, Longmans.
- Irán. Levine. (2009). Princípy fyzikálneho spôsobu. Šieste vydanie. MC Graw Hill.
- Wikipedia. (2020). Adiabatický proces. Zdroj: In.Wikipedia.orgán
- Jones, Andrew Zimmerman. (18. augusta 2020). Themodynamika: adiabatický proces. Zotavené z: Thoughtco.com
- DeVoe Howard a Neils Tom. (9. augusta 2020). Adiabatické zmeny. Chémia librettexts. Získané z: Chem.Librettexts.orgán

