Princíp le -châtelier

- 3421
- 1011
- Ing. Ervín Petruška
Aký je princíp Le Châtelier?
On Princíp le -châtelier Je to všeobecné pravidlo, ktoré predpovedá účinok, ktorý majú rôzne faktory, ktoré ovplyvňujú chemickú rovnováhu. Najmä pomáha predpovedať, v akom smere sa reakcia, ktorá je v rovnováhe.
Tento princíp to ustanovuje:
„Ak systém, ktorý je v rovnováhe, podlieha narušeniu alebo vonkajšiemu napätiu, systém reaguje v smere, ktorý mu umožňuje čiastočne pôsobiť proti takémuto narušeniu“.
Narušenie je dobre pochopené:
- Zmena koncentrácie ktoréhokoľvek z reagencií.
- Zmena koncentrácie ktoréhokoľvek z výrobkov.
- Zmeny tlaku.
- Zmeny objemu.
- Zmena teploty
Keď sa vyskytnú zmeny, ako sa uvádza, jedna z týchto dvoch reakcií, priama alebo inverzná, je uprednostňovaná s ohľadom na druhú, takže systém reaguje v tomto zmysle, ktorý sa pohybuje smerom k novému stavu rovnováhy.
Je to podobné úpravám, ktoré vykonal vyvažovač na lane. Keď na jednej strane hala hala, vyvažovač reaguje presunutím na opačnú stranu. Hovoríme, že jeho rovnováha sa pohybovala, pretože je stále v rovnováhe (nespadá), ale teraz má inú pozíciu.
Ďalej uvidíme, ako sa princíp Le Châtelier používa na predpovedanie smeru, v ktorom systém bude reagovať utrpením rôznych typov napätia alebo porúch, ako sú: zmeny v koncentrácii, objeme, tlaku a teplote.
Účinok zmien v koncentrácii
Predpokladajme, že v rovnováhe máme nasledujúcu reakciu:
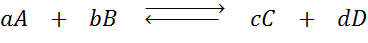
Ak zmeníme koncentráciu ktoréhokoľvek z príslušných druhov (a, b, c alebo d), princíp Le Châtelier predpovedá, že systém bude reagovať na pôsobenie proti tejto zmene buď buď spotrebúvajúcim nadbytkom pridaným alebo obnovením eliminovaného množstva. 4 Rôzne situácie je možné uviesť:
1. Zvýšená koncentrácia reagencií
Ak zvýšime koncentráciu činidla, napríklad podľa zásady Le Châtelier, systém bude reagovať na konzumáciu pridaného prebytku. To znamená, že bude reagovať priamo (zľava doprava), pretože tento smer sa konzumuje.
V tomto prípade sa hovorí, že priama reakcia je uprednostňovaná a že rovnováha sa pohybuje smerom k výrobkom, pretože v novej rovnováhe je koncentrácia výrobkov vyššia ako v pôvodnej rovnováhe.
Môže vám slúžiť: magnetické oddelenie2. Zvýšená koncentrácia výrobkov
Ak zvýšime koncentráciu produktu, napríklad C, systém bude reagovať opačne, aby konzumoval nadbytok C pridaný (to znamená sprava doľava).
V tomto prípade sa uvádza, že je uprednostňovaná spätná reakcia a že rovnováha sa pohybuje smerom k reagenciám.
3. Zníženie koncentrácie činidla
Zníženie koncentrácie má opačný účinok k zvýšeniu uvedenej koncentrácie. Ak odstúpime od média, čím sa zníži jeho koncentrácia, systém bude reagovať na ľavú (opačne), aby pôsobil proti zmene. Rovnováha sa pohybuje smerom k reagenciám.
4. Zníženie koncentrácie výrobkov
Ak znížime koncentráciu C alebo D, systém bude reagovať priamo a nahradiť zníženú koncentráciu (to znamená zľava doprava). Rovnováha sa pohybuje smerom k výrobkom.
Príklad:
Stanovte účinok pridania ďalších tiocianutových iónov (SCN-) V nasledujúcej chemickej rovnováhe s vedomím, že produkt práva je intenzívna červená a železo (iii) je žltá.
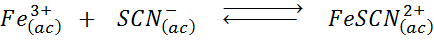
Riešenie: V tomto prípade pridávame tiociato, ktorý je činidlom, takže rovnováha sa musí pohybovať doprava, čím sa zvyšuje koncentrácia komplexu, a teda intenzita červenej farby v roztoku.
Vplyv zmien objemu a tlaku
Zmeny objemu a tlaku významne neovplyvňujú reakcie v rovnováhe v kvapalnom alebo tuhom stave, ale môžu ovplyvniť tie, ktoré sa nachádzajú v plynnom stave. Je to preto, že pre plyny je koncentrácia úmerná tlaku, ako sa predpovedá zákonom ideálnych plynov.
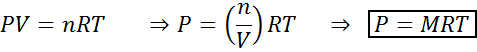
Zvýšenie tlaku plynu udržiavajúceho konštantnú teplotu je rovnocenné na zníženie jeho objemu, takže účinok oboch porúch bude rovnaký.
Ak sa celkový tlak zvýši na rovnovážnu reakciu v rovnováhe (alebo znižujeme jej objem), systém bude reagovať na pokus o zníženie tohto tlaku, takže rovnováha sa presunie na miesto, kde je menšie množstvo plynných častíc molekúl častíc.
Môže vám slúžiť: chromatografia s jemnou vrstvou: Charakteristiky, čo je pre V reakcii medzi dusík a vodíkom na vytvorenie amoniaku sa spotrebúvajú 4 molekuly sódy a vyrábajú sa iba dve, takže zvýšenie tlaku vytlačí rovnováhu smerom k väčšej tvorbe amoniaku
V reakcii medzi dusík a vodíkom na vytvorenie amoniaku sa spotrebúvajú 4 molekuly sódy a vyrábajú sa iba dve, takže zvýšenie tlaku vytlačí rovnováhu smerom k väčšej tvorbe amoniaku Ak sa v reakcii konzumujú a vyrábajú sa rovnaký počet molekúl plynu, potom zmeny objemu a tlaku neovplyvnia rovnováhu.
Na druhej strane, ak upravíme iba čiastočný tlak ktoréhokoľvek z plynov, účinok je rovnaký ako na zvýšenie alebo zníženie koncentrácie uvedených druhov.
Príklad:
Vzhľadom na rozkladovú reakciu dyitrogénového tetroxidu v rovnováhe:
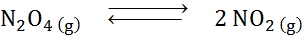
Určite účinok redukčného objemu, zvyšujúci sa tlak.
Riešenie: Ak zvýšime celkový tlak systému alebo znížime jeho objem, rovnováha sa pohybuje smerom k činidlám, pretože v tomto smere dochádza k čistému zníženiu molekúl plynu (2 a 1), ktoré umožňuje pôsobiť proti zvýšeniu tlaku.
Vplyv zmien teploty
Vplyv teploty na chemickú rovnováhu sa líši od ostatných faktorov, ktoré sme doteraz videli. V predchádzajúcich prípadoch sa po narušení získa nová rovnováha, ale udržiava sa rovnaká rovnovážna konštanta. Ak sa však teplota zmení, rovnovážna konštanta sa zmení.
Aby sme vedeli, ako sa rovnovážna konštantná mení s teplotou, je potrebné známe znak reakčnej entalpie:
- Ak reakcia uvoľní teplo, to znamená, že je exotermická, jej entalpia je negatívna a rovnovážna konštanta klesá so zvyšovaním teploty. V týchto prípadoch sa rovnováha pohybuje v opačnom smere smerom k reagenciám.
- Ak reakcia absorbuje teplo, to znamená, že je endotermická, jej entalpia je pozitívna a nastane opak.
Zapamätanie si účinku teploty je ľahké, ak považujeme teplo za činidlo, ktoré sa vyskytuje v prípade exotermických reakcií a spotrebúva sa v prípade endotermických. Zvýšenie teploty by bolo ako „pridať“ teplo do systému a ochladiť by bolo rovnocenné na jeho odstránenie.
Takže, ak je reakcia exotermická a teplota sa zvýši, bolo by to ako pridať produkt reakcie, takže rovnováha sa pohybuje v opačnom smere, smerom k činidlám a ak ochladí opak.
Môže vám slúžiť: kyselina píchrová: čo je, štruktúra, syntéza, vlastnostiNa druhej strane, ak je reakcia endotermická a teplota sa zvýši, bolo by to ako pridať činidlo, takže rovnováha sa pohybuje smerom k produktom, zatiaľ čo zníženie teploty má opačný účinok.
Príklad:
Rozkladová reakcia n2Ani4 Má entalpiu reakcie +58,0 kJ/mol. V akom smere sa rovnováha bude pohybovať, ak sa teplota zníži?
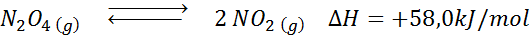
Riešenie: Pretože entalpia je pozitívna, reakcia je endotermická. Z tohto dôvodu ochladenie uprednostňuje spätnú reakciu a rovnováha sa posunie smerom k činidlám, to znamená smerom k vytvoreniu viac n2Ani4.
Vplyv katalyzátorov, inhibítorov a inertných látok
Katalyzátory a inhibítory ovplyvňujú rýchlosť, s akou sa vyskytujú reakcie, ale ovplyvňujú priamu aj nepriamu reakciu. Z tohto dôvodu neovplyvňujú rovnovážny stav.
Na druhej strane, pridanie inertnej látky ako plynu, ktorý nereaguje so žiadnym z činidiel alebo produktov, nebude mať vplyv na priamu alebo priamu reakciu, takže bude mať akýkoľvek vplyv na rovnováhu.
Uplatňovanie princípu Le Châteliera
Pochopenie tohto princípu je veľmi užitočné, pretože nám umožňuje manipulovať s stavom rovnováhy reakcie na naše pohodlie.
V prípadoch, v ktorých nás zaujíma.
To znamená:
- Ak sú ekonomické, pridajte veľké množstvo činidiel.
- Vyberajte produkt s postupovaním reakcie, aby sa udržal systém v konštantnom stave napätia, vždy sa snaží dosiahnuť priame reagovanie na rovnováhu.
- Zvýšiť teplotu v prípade endotermických reakcií.
- Zvýšte tlak na tieto reakcie, v ktorých sa konzumuje viac molekúl plynu, ako sa vyskytujú.
Možno budeme chcieť minimalizovať množstvo produktu, ktorý je tvorený nechcenou reakciou. V týchto prípadoch robíme opak.
Príklad aplikácie princípu Le Châtelier
Pri organickej syntéze sa na zlepšenie výťažkov reakcií používa princíp Le Châtelier.
Napríklad pri reakciách na dehydratáciu alkoholu sa do prostredia, ktoré absorbujú vodu vytvorenú počas reakcie, pridávajú vysychadlá, ktoré absorbujú vodu vytvorenú počas reakcie. To znižuje koncentráciu uvedeného produktu, ktorý vytesňuje rovnováhu k výrobkom.

