Chemické zrážky

- 2000
- 478
- JUDr. Rudolf Čapkovič
 Sedimentačná nádrž na úpravu vody
Sedimentačná nádrž na úpravu vody Čo je chemické zrážky?
Ten Chemické zrážky Je to proces čistenia odpadových vôd, v ktorom sa pridávajú chemické látky na transformáciu znečisťujúcich látok rozpustených do tuhých častíc. Inými slovami, spočíva v vytváraní sedimentovných častíc v odpadovej vode pridaním chemikálií.
Hlavný cieľ chemického dažďa.
Aj keď väčšina znečisťujúcich látok, ktoré sa snažia eliminovať, sú kovy, ako je kobalt, cézium alebo ortuť, ktoré tvoria katióny (ióny s pozitívnym zaťažením), používa sa tiež na eliminovanie aniónov (iónov s negatívnym zaťažením), ako je fluorid, kyanid a fosfáty.
Akonáhle sú pevné zrážky, je potrebné vykonať sériu krokov, aby ste ich mohli oddeliť od zvyšku vody. Tieto kroky zahŕňajú flokuláciu, sedimentáciu a separáciu tuhých kvapalín.
Rovnováha rozpustnosti a chemických zrážok
Technika chemického zrážania je založená na rovnováhe rozpustnosti iónových zlúčenín a konštante produktu rozpustnosti. Vo väčšine prípadov sú tuhé látky, ktoré zrážajú malé rozpustné hydroxidy, hoci iné typy iónov sú tiež vyzrážané.
Vo všetkých prípadoch chemického zrážania je vytvorená tuhá látka trochu rozpustná iónová zlúčenina, ktorá je v rovnováhe s iónmi v roztoku podľa všeobecnej reakcie:
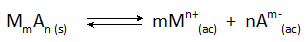
Konečná koncentrácia kovu M, ktorá zostáva v roztoku, je určená rovnovážnou konštantou tejto reakcie, ako aj koncentráciou aniónu A, ktorá sa pridáva.
Napríklad, Ak ide o hydroxid, konečná koncentrácia kovu bude závisieť od koncentrácie hydroxidových iónov v roztoku, a teda aj od pH.
Krok za krokom proces chemického zrážania
Proces chemického zrážania pozostáva zo štyroch základných krokov:
Krok 1: Pridanie zrážajúceho sa činidla a úpravy pH.
Toto je počiatočná fáza, v ktorej sa pridá zvolené činidlo, ktoré je vybrané (vo väčšine prípadov je to hydroxid vápenatý). PH sa nastavuje na maximalizáciu zrážok a optimalizáciu konečnej čistoty vody.
Môže vám slúžiť: Acrilonitrila: Štruktúra, vlastnosti, výroba, použitiePočas tohto kroku sa zmes normálne porazí alebo mieša, aby sa zabezpečila rovnomerná koncentrácia zrážania.
Krok 2: Flulácia.
Táto fáza je umožnenie malých tuhých látok, ktoré sa tvoria v prvej fáze zrážok, aby sa spojili s formujúcimi časticami alebo „vločkami“ (odtiaľ ich meno).
Tieto budú v ďalšom kroku rýchlejšie sedimentovať. Aby sme uprednostňovali tvorbu týchto častíc bez toho, aby ste ich prerušili, agitácia sa stáva pomalšie.
Krok 3: Sedimentácia.
Spočíva v tom, že umožňuje zmes novo ošetrenej vody stáť v nádrži, aby sa všetky tuhé častice dostali na pozadie (Sedimente).
Krok 4: Oddelenie tuhých kvapalín.
Vo väčšine prípadov separácia tuhej kvapaliny pozostáva z jednoduchého dekantácie vody, ktorá zostáva sedimentom. V iných prípadoch sa separácia dosiahne filtrovaním alebo dokonca odstredením ošetrenej vody v závislosti od toho, aké nebezpečné znečisťujúce látky sú.
Typy chemických zrážok
Zrážanie hydroxidu
Toto je najbežnejší typ chemických zrážok a spočíva v zvýšení pH pridaním alkalickej zlúčeniny, ktorá je takmer vždy hydroxidom vápenatého (CA (OH)2).
Chemická reakcia, ktorá sa vyskytuje, je:

V predchádzajúcej reakcii M predstavuje akýkoľvek katión kovu, ktorý sa požaduje eliminovať. Pevná látka, ktorá sa tvorí v tomto prípade, je veľmi malý rozpustný hydroxid.
V prípade zrážok hydroxidu je všeobecné pravidlo, že čím väčšia je koncentrácia OH- (Čím väčšie pH), tým nižšia je koncentrácia kovu, ktorý zostáva vo vode, po ošetrení. Inými slovami, k väčšiemu pH, väčšia konečná čistota vody.
Zrážky so sulfidmi
Tento typ chemických zrážok sa používa hlavne na elimináciu ťažkých kovov, ako je olovo alebo ortuť, vo forme veľmi malých rozpustných sulfidov. Na dosiahnutie tohto cieľa sa môže pridať do vody na ošetrenie rozpustných aj nerozpustných sulfidov.
Najčastejšie používané sulfidy sú rozpustné látky, ktoré zahŕňajú sulfid vodíka (H2S) a sulfid sodný (NA2S). Všeobecná zrážacia reakcia je:
Môže ti slúžiť: zliatiny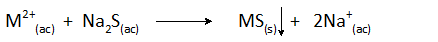
Môže sa pridať aj sulfid železita, ktorý je nerozpustný, ale poskytuje dostatok sulfidových iónov roztoku na vyvolanie väčšiny ťažkých kovov.
Zrážanie uhličitanu
Uhličitan mnohých kovov sú menej rozpustné dokonca ako hydroxidy a môžu sa zrážať z odpadovej vody pridaním uhličitanu vápenatého alebo otočením hydroxidov bublajúceho uhličitého v alkalizovanej zmesi v alkalizovanej zmesi.
Zrážanie kyanidu
Na rozdiel od predchádzajúcich prípadov sa tu snažíme zrážať kyanid, ktorý je anión, namiesto kovu. Kyanid je veľmi nebezpečný jedovatý kontaminant a môže byť odstránený z odpadovej vody pridaním síranu zinočnatého alebo síranu železnice, pretože s týmito kovmi tvorí komplex.
Koprepitácia
Koprecipitácia sa vyskytuje, keď sa rozpustená látka zráža spolu s ďalším. V týchto prípadoch sa prvá rozpustená látka uloví v pevnej látke, keď sa vytvorí zrazenina inej zlúčeniny.
Je to, akoby tuhá látka pri formovaní opustila prvú rozpustenú látku a vytiahla ho z roztoku. Tento jav sa používa na odstránenie niektorých znečisťujúcich látok, ktoré sa ťažko zrážajú.
Žiadosti
Chemické zrážky sa používajú v nekonečných odvetviach, aby sa splnili environmentálne požiadavky kvality odpadovej vody.
Zrážanie hydroxidu Používa sa v odvetviach:
- Kovové povrchové úpravy
- Výroba anorganických zlúčenín
- Podriadenia
- Výroba ohňostrojov a výbušnín
- Porcelánová smalt
- Ťažba uhlia
- Okrem iného farmaceutický priemysel.
Na druhej strane, Zrážky so sulfidmi V priemysle sa používa na odstránenie kontaminantov, ako sú ortuť, olovo a striebro. To má žiadosť v nasledujúcich odvetviach:
- Textilný priemysel
- Ťažba
- Fotografické vybavenie a zásoby
- Výroba neoterných kovov okrem iného
Okrem týchto odvetví je zrážky najdôležitejšou technikou pre Čistenie chladiacej vody jadrových reaktorov. V tomto odvetví sa používa na odstránenie rádioaktívnych katiónov, ako sú Plutónia, Américo, Cesio a ďalšie.
Príklady chemických zrážok
Zrážanie stroncia s uhličitanom vápenatého
Zrážacia reakcia v tomto prípade je:
Môže vám slúžiť: oxidy dusíka (NOx)
Reakcia sa vykonáva na optimálne pH 10,5 a dosahuje koncentrácie tohto kovu až 100 -krát nižšiu ako pôvodná.
Zrážanie hydroxidu antimónu
Na odstránenie antimónu z odpadovej vody sa môže hydroxid titánu použiť ako zrážajúce činidlo. Reakcia je:

Toto sa vykonáva v rozsahu pH, ktorý prechádza od 5 do 8,5 a tiež redukuje koncentráciu na hodnotu 100 -krát nižšiu ako pôvodná.
Zrážanie cézium s tetrafenylborátom
Toto je osobitný prípad, ktorý umožňuje zrážanie turista, čo je alkalický kov, ktorý je ťažko zrážaný. Reakcia je:

Použitie tetrafenylborarátu prináša dve veľké výhody: po prvé, čo funguje prakticky pre akékoľvek pH (od pH 1 až 13) a po druhé, že rozpustnosť s nízkou soľou, ktorá sa vytvára, umožňuje znížiť konečnú koncentráciu kontaminantu o tisíc tisíc faktorov tisíc tisíc.
Zrážanie medi s sulfidom sodným
Zrážacia reakcia v tomto prípade je:
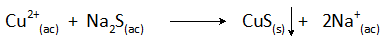
Odstránenie medi odpadovej vody touto metódou sa vykonáva pri hodnotách pH väčších ako 8 a jej koncentrácia sa zníži o viac ako 99%.
Koprecipitácia chrómu, olova a zinku s hydroxidom železitým a hydroxidom hlinitého
V tomto prípade sa do vody pridáva hydroxid sodný, aby sa zrážalo železo a hliník, ktorý je prítomný vo forme železitého hydroxidu (viera (OH)3) a hliníkový hydroxid (AL (OH)3). Keď sa tieto dva hydroxidy zrážajú, ťahajú časť chrómových, olovených a zinkových iónov. Zadné ošetrenie sulfidom vodíka odstraňuje takmer všetky tieto tri kovy.
Odkazy
- Wang, l. Klimatizovať., Vaccari, D. Do., Li, a., & Shammas, n. Klimatizovať. (2005). Chemické zrážky. Procesy fyzikálneho spracovania, 141-197. Doi: 10.1385/1-59259-820-X: 141
- Striebig, b.Do. (2005). Chemické zrážky. Vo vode Encyclopedia (eds. J.H. Lehr a J. Keeley). https: // doi.org/10.1002/047147844X.PC101
- Britannica, T. Editory de Encyclopaedia (2018, 8. februára). Chemické zrážky. Encyclopedia Britannica. https: // www.Britannica.com/Science/Chemical-Deccitation
- D. Bhattacharyya, a. B. Jumawan Jr. & R. B. Grieves (1979) Separácia toxických ťažkých kovov pomocou sulfidovej prevencie, separačná veda a technológia, 14: 5, 441-452, doi: 10.1080/01496397908058096
- Marina Maya Marchioretto, Harry Bruning & Wim Rulkens (2005) Presnosť ťažkých kovov v kanalizačných kaloch, separačná veda a technológia, 40:16, 3393-3405, doi: 10: 10: 10: 10: 10: 10: 10: 10: 10: 10: 10: 10: 10: 10: 10.1080/01496390500423748

