Polarita (chémia) Čo je, definícia, príklady
- 1793
- 303
- Denis Škriniar
Čo je chemická polarita?
Ten Chemická polarita Je to vlastnosť, ktorá sa vyznačuje prítomnosťou výrazného heterogénneho rozdelenia elektronických hustoty v molekule. Vo svojej štruktúre sú preto negatívne zaťažené oblasti (δ-) a ďalšie pozitívne nabité (A+), ktoré vytvárajú dipólový moment.
Dipólový moment (u) spojenia je forma expresie polarity molekuly. Zvyčajne je reprezentovaný ako vektor, ktorého pôvod je v zaťažení (+) a jeho koniec sa nachádza v zaťažení (-), hoci niektoré chemikálie ho predstavujú naopak.
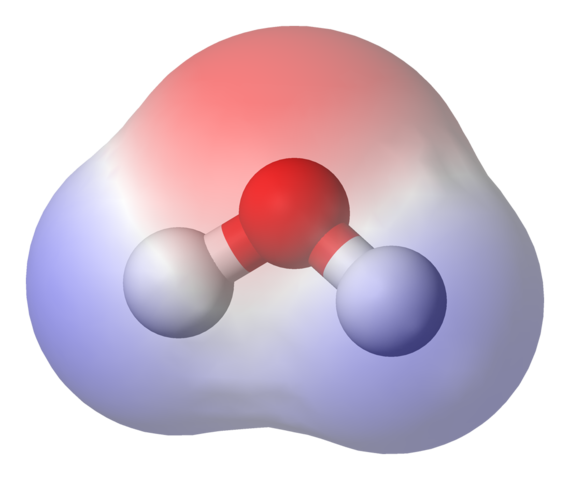
 Mapa elektrostatického potenciálu pre molekulu vody. Zdroj: Benjah-Bmm27 Via Wikipedia.
Mapa elektrostatického potenciálu pre molekulu vody. Zdroj: Benjah-Bmm27 Via Wikipedia. Na hornom obrázku je zobrazená elektrostatická potenciálová mapa vody, h2Ani. Červenkastá oblasť (atóm kyslíka) zodpovedá oblasti s najvyššou elektronickou hustotou a je tiež zrejmé, že vyniká na modrých oblastiach (atómy vodíka).
Pretože distribúcia uvedenej elektronickej hustoty je heterogénna, hovorí sa, že existuje pozitívny a negatívny stĺp. Preto hovoríme o chemickej polarite a momentálne dipól.
Dipolárny moment
Dipólový moment µ je definovaný nasledujúcou rovnicou:
µ = δ ·d
Kde δ je elektrický náboj každého pólu, kladné (+δ) alebo negatívne (-5) a d Je to vzdialenosť medzi nimi.
Dipólový moment sa zvyčajne vyjadruje v Debye, predstavuje symbol D. Coulomb · Metro je rovnocenná s 2 998 · 1029 D.
Hodnota dipólového momentu prepojenia medzi dvoma rôznymi atómami je vo vzťahu k rozdielu v elektronických štátoch atómov, ktoré tvoria spojenie.
Aby bola molekula polárna, nestačí mať v štruktúre polárne spojenia, ale musí mať aj asymetrickú geometriu; Týmto spôsobom, ktorý zabraňuje navzájom zrušenia dipólových momentov.
Môže vám slúžiť: karbonoidy: prvky, vlastnosti a použitiaAsymetria v molekule vody
Molekula vody má dve väzby O-H. Geometria molekuly je uhlová, to znamená s formou „v“; Takže dipólové momenty odkazov sa navzájom nezrušia, ale ich súčet sa vyskytuje smerom k atómu kyslíka.
Mapa elektrostatického potenciálu pre H2Alebo to odráža.
Ak je pozorovaná uhlová molekula H-O-H, môže vzniknúť nasledujúca otázka: Je to skutočne asymetrická? Ak je nakreslená imaginárna os, ktorá prechádza atómom kyslíka, molekula sa rozdelí na dve rovnaké polovice: H-O | O-H.
Ale nie je to tak, ak je imaginárna os vodorovná. Keď táto os teraz rozdelí molekulu opäť na dve polovice, atóm kyslíka bude mať na jednej strane a na druhej strane dva atómy vodíka.
Preto zjavná symetria H2Alebo prestane existovať, a preto sa posudzuje asymetrická molekula.
Polárne molekuly
Polárne molekuly musia spĺňať sériu charakteristík, napríklad:
-Rozloženie elektrických nábojov v molekulárnej štruktúre je asymetrické.
-Zvyčajne sú rozpustné vo vode. Je to splatné medzi polárnymi molekulami môžu interagovať dipólovými dipolomi, kde je voda charakterizovaná tým, že má veľký dipólový moment.
Okrem toho je jej dielektrická konštanta veľmi vysoká (78,5), čo vám umožňuje udržiavať samostatné elektrické zaťaženie zvyšujúcej rozpustnosť.
-Všeobecne platí, že polárne molekuly majú vysoké body varu a fúzie.
Tieto sily sú tvorené interakciou dipolo-dipolo, disperznými silami v Londýne a tvorbou vodíkových mostov.
Môže vám slúžiť: sulfát železa (FESO4): Čo je, štruktúra, vlastnosti, syntéza-Kvôli svojmu elektrickému náboju môžu polárne molekuly riadiť elektrinu.
Príklady
SW2
Oxid siričitý (SO2). Kyslík má elektronegativitu 3,44, zatiaľ čo sírna elektronegativita je 2,58. Preto je kyslík viac elektronegatívny ako síra. Existujú dva odkazy s = o, majú alebo jedno zaťaženie Δ- a s a s (s ním δ+.
Pretože je to uhlová molekula s S vo vrchole, dva dipólové momenty sú orientované rovnakým smerom; A preto sa sčítajú a vytvárajú tak molekulu2 byť polárny.
CHCL3
Chloroform (hccl3). K dispozícii je odkaz C-H a tri odkazy C-Cl.
Elektronegativita C je 2,55 a elektronegativita H je 2,2. Uhlík je teda viac elektronegatívny ako vodík; A preto bude dipólový moment orientovaný z H (A+) do C (δ-): CΔ--HΔ+.
V prípade odkazov C-Cl má C elektronegativitu 2,55, zatiaľ čo CL má elektronegativitu 3,16. Dipólový alebo dipólový moment je orientovaný z C na CL v troch odkazoch C Δ+-Cl Δ-.
Ak existuje zlá oblasť elektrónov, okolo atómu vodíka a oblasť bohatá na elektróny zložené z troch atómov chlóru, CHCL3 Považuje sa za polárnu molekulu.
HF
Fluorid vodíka má iba jednu väzbu H-F. Elektronegativita H je 2,22 a elektronegativita f je 3,98. Preto fluorid končí s najväčšou elektronickou hustotou a spojenie medzi oboma atómami je najlepšie opísané ako: hΔ+-FΔ-.
Môže vám slúžiť: hydroxid z hliníka: štruktúra, vlastnosti, použitia, rizikáNH3
Amoniak (NH3) má tri N-H odkazy. Elektronegativita N je 3,06 a elektronegativita H je 2,22. V troch väzbách je elektronická hustota orientovaná na dusík, čo je ešte väčšia prítomnosťou pár voľných elektrónov.
Molekula NH3 Je totrahedrálny, s atómom N, ktorý zaberá vrchol. Tri dipólové momenty, ktoré zodpovedajú N-H odkazom, sú orientované rovnakým smerom. V nich je A- umiestnený v N a A+ v H. Odkazy sú teda: nΔ--HΔ+.
Tieto dipólové momenty, asymetria molekuly a krútiaci moment bez elektrónov na dusíku, robia z amoniaku vysoko polárnu molekulu.
Makromolekuly s heteroátomosom
Keď sú molekuly veľmi veľké, už nie je presné ich klasifikovať ako apolárne alebo polárne. Je to preto, že môžu existovať časti jej štruktúry s apolárnymi (hydrofóbnymi), ako sú polárne (hydrofilné) charakteristiky.
Tieto typy zlúčenín sú známe ako amfifilos alebo amfipatické. Pretože apolárna časť sa môže považovať za slabú v elektronoch vzhľadom na polárnu časť, v štruktúre je prítomná polarita a amfiprylové zlúčeniny sa považujú za polárne zlúčeniny.
Všeobecne sa dá očakávať, že makromolekula s heteroatómami má dipólové momenty a s ním chemická polarita.
Heteroátomos chápu tie, ktoré sa líšia od tých, ktorí tvoria kostru štruktúry. Napríklad sýtená kostra je biologicky najdôležitejšia zo všetkých a atóm, s ktorým sa uhlík (okrem vodíka) spája, nazýva sa heteroátomo.
Odkazy
- Polárne a nepolárne zlúčeniny. Sv. Louis Community College. Obnovené z: používateľov.STLCC.Edu
- Ako vysvetliť polaritu. Vedecký. Obnovené z: vedeckých.com

