Pencanona Chemická štruktúra, vlastnosti, syntéza, použitie
- 4975
- 321
- Mgr. Pravoslav Mokroš
Ten Pentanona Je to organická zlúčenina, ktorá patrí do rodiny ketónov, ktorej chemický vzorec je C5H10Ani. Zostáva jedným z najjednoduchších ketónov a pozostáva z bezfarebnej tekutiny s arómou podobnou acetone. Odteraz, vzhľadom na uhlíkové číslo ich kostry, ketónov prítomný izomér.
Keď hovoríme o pozícii Izoméria sa vzťahuje na to, kde je karbonylová skupina, c = o. Puntanona teda pozostáva z dvoch zlúčenín s fyzikálnymi vlastnosťami, ktoré sa navzájom veľmi líšia: 2-penón a 3-penón (nižší obrázok). Obidve sú tekuté, ale ich body varu sú rovnaké, takže ich nemôžu oddeliť destiláciou.
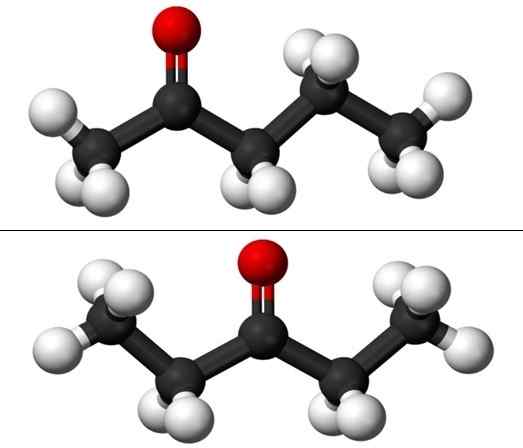
 Molekuly izomérov polohy pre Pentanona. Zdroj: Jynto & Ben Mills Via Wikipedia.
Molekuly izomérov polohy pre Pentanona. Zdroj: Jynto & Ben Mills Via Wikipedia. Každý z týchto dvoch pentanónov má však svoju vlastnú syntézu, takže je nepravdepodobné, že ich existuje; zmes, ktorá môže byť uskutočniteľná na oddelenie zmrazením.
Jeho použitia sú obmedzené najmä ako organické rozpúšťadlá; Alternatívy k acetónu v médiách, kde pracujete s teplotou vyššou ako jej nízky bod varu. Sú tiež východiskovými materiálmi pre inú organickú syntézu, pretože ich skupina C = o môže znížiť alebo trpieť nukleofilným prírastkom.
[TOC]
Chemická štruktúra
Izoméry
Na obrázku máme molekulárne štruktúry oboch izomérov pre Puntanona, ktoré predstavujú model guľôčok a stĺpcov. Čierne gule zodpovedajú uhličitým kostrom, bielym atómom vodíka a atómami červeného kyslíka v skupine C = o.
2-pintanón
2-Ponanona (vyššie) má skupinu C = alebo v druhom uhlíku, čo je ekvivalentné, ak bola v miestnosti; to znamená, že 2-ponanona a 4-Pantanona sú rovnocenné, pretože im stačí otáčať ich o 180 °, aby ich štruktúry boli rovnaké.
Môže vám slúžiť: uhlíkový tetrachlorid (CCL4)Vľavo od C = o máte metyl radikál, cho Cho3-, A po jeho pravici, radikálny propil. Preto táto Cetona dostáva názov (menej použité) od Metil propil Cetona (MPK v angličtine). Môžete vidieť asymetriu tejto štruktúry na prvý pohľad.
3-penón
3-péntanona (nižšie) má skupinu C = o v treťom uhlíku. Všimnite si, že tento izomér je väčšia verzia acetónu a že je tiež veľmi symetrická; Dva radikály na stranách skupiny C = o sú rovnaké: dva etyl radikály, ch3Chvály2-. Preto sa 3-pananona nazýva Cetona DieStil (alebo dimetylacetón).
Intermolekulárne interakcie
Prítomnosť karbonylovej skupiny, a to v 2-pantanone aj v 3-Penone, prideľuje polaritu molekule.
Preto sú oba izoméry Pentanona schopné vzájomne interagovať prostredníctvom dipólu-dipol.
Podobne, londýnske disperzné sily medzi uhlíkom a hydrogenovanými kostrami zasahujú v menšej miere.
Tým, že má Puntanona, väčšiu molekulárnu oblasť a hmotnosť v porovnaní s acetónom, tento príspevok dodáva svojmu dipólovému momentu a umožňuje vyšší bod varu (102 ° C> 56 ° C) mať vyšší bod varu). V skutočnosti sa tieto dva izoméry odparujú pri 102 ° C; zatiaľ čo zmrazujú pri rôznych teplotách.
Kryštály
Pravdepodobne v kryštalizácii hrajú symetrie dôležitú úlohu. Napríklad fúzny bod 2 -Pantanona je -78 ° C, zatiaľ čo 3 -péntanona, -39 ° C.
Môže vám slúžiť: avogadro zákonTo znamená, že kryštály 3-Pantanona sú stabilnejšie proti teplote; Jeho molekuly sú súdržnejšie a vyžadujú viac tepla na oddelenie v kvapalnej fáze.
Keby existovala zmes oboch izomérov, 3-penón by bol prvý, kto by kryštalizoval, konečne by bol 2-pananona pri nižšej teplote. Molekuly 3-pantanónu, symetrickejšie, sú orientované ľahšie ako molekuly 2-ponanony: asymetrické a zároveň dynamickejšie.
Vlastnosti
Fyzický vzhľad
Bezfarebné kvapaliny s arómou podobnou acetónu.
Molárna hmota
86,13 g/mol
Hustota
0,81 g/ml (3-ponanona)
0,809 g/ml (2-ponanona)
Bod topenia
-78 ° C (2-ponanona)
-39 ° C (3-ponanona)
Bod varu
102 ° C (pre oba izoméry)
Rozpustnosť
35 g/l (3-ponenona)
60 g/l (2-ponenona)
Tlak vodnej pary
35 mmHg (3-ponenona)
270 mmHg (2-pantanón) pri 20 ° C
Tieto hodnoty nie sú užitočné na priame porovnanie tlakov pary oboch izomérov, pretože prvé sa uvádza bez teploty, pri ktorej sa merala.
Bod vzplanutia
12,78 ° C (3-ponanona)
10 ° C (2-ponanona)
Stabilita
Dva izoméry Pentanona sú mimoriadne horľavé, takže musia zostať tak ďaleko od akéhokoľvek zdroja tepla. Flash body naznačujú, že plameň môže nastaviť výpary oboch pentánov aj pri teplote 10 ° C.
Syntéza
Aj keď sú dva izoméry Pentanona fyzicky a chemicky veľmi podobné, ich syntetické trasy sú nezávislé od ostatných, takže je nepravdepodobné, že by sa obe získali v rovnakej syntéze.
2-pintanón
Počnúc z 2-penolového činidla, sekundárneho alkoholu, sa môže oxidovať na 2-ponanón s použitím kyseliny chlórnej tvorenej in situ, HCLO, ako oxidačné činidlo. Oxidácia by bola:
Môže vám slúžiť: žiadne elektrolyty: charakteristiky a príklady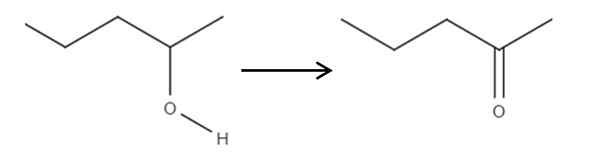 Oxidácia 2-pentanolu v 2-Pantanone. Zdroj: Gabriel Bolívar.
Oxidácia 2-pentanolu v 2-Pantanone. Zdroj: Gabriel Bolívar. Jednoducho sa c-oh odkaz stáva c = o. Existujú aj ďalšie metódy na syntézu 2-penóny, ale toto je najjednoduchšie porozumieť.
3-penón
3-pintanón sa dá syntetizovať pomocou3Chvály2Kohútik. Táto syntetická cesta vytvára symetrické ketóny a je to molekula Cho3CoOH stratí skupinu COOH vo forme CO2, Zatiaľ čo druhá vaša skupina oh vo forme H2Buď:
2c3Chvály2Cooh => ch3Chvály2Cocha2Chvály3 + Co2 + H2Ani
Ďalšou mierne komplexnejšou cestou je priama reagovanie na zmes etylénu, cho2= CH2, Co2 a h2 Na vytvorenie 3-ponanony.
Žiadosti
Pokiaľ nie je aplikácia veľmi prísna, je to špecifická syntéza alebo že sa tiež ukázalo, že dva izoméry nespôsobujú rovnaké výsledky, je irelevantné vybrať si medzi použitím 2-penónu alebo 3-penónu v ktorejkoľvek z nich. využívanie.
To znamená „nezáleží na“, ak chcete použiť 2-Ponanona alebo 3-Penona ako rozpúšťadlo obrazov alebo živíc, alebo ako úbohé, pretože najdôležitejšie kritériá sa stanú jeho cenou a dostupnosťou. 3-penón sa používa v automobilovom priemysle na štúdium správania plynov vo vnútri vnútorných spaľovacích motorov.
Odkazy
- Morrison, r. Tón. a Boyd, R, N. (1987). Organická chémia. 5. vydanie. Redakčný Addison-Wesley Inter-American.
- Carey F. (2008). Organická chémia. (Šieste vydanie). MC Graw Hill.
- Graham Solomons t.W., Craig B. Fryhle. (2011). Organická chémia. Amín. (10. vydanie.). Wiley Plus.
- Wikipedia. (2019). 3-mafový. Zdroj: In.Wikipedia.orgán
- Národné centrum pre biotechnologické informácie. (2019). 2-pontenón. Databáza pubchem. CID = 7895. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Kráľovská spoločnosť chémie. (2019). 3-mafový. Obnovený z: ChemSpider.com
- Profesor T. Nalli. (2013). Oxidácia 2-pintanolu a destilácia produktu. Získané z: kurzu1.Winona.Edu

