Charakteristiky oxihemoglobínu, štruktúra a krivka krivky
- 2181
- 397
- Alan Milota
AniXihemoglobín Je to meno, ktoré dostáva hemoglobín, keď sa pripojí k kyslíku. Hemoglobín je proteín, ktorý je v červených krvinkách a ktorého hlavnou funkciou je transport kyslíka z pľúc do tkanív.
Prvé živé bytosti boli jednobunkové a žili v tekutej atmosfére, z ktorej boli vyživovaní a do ktorých vylúčili svoj odpad, ako aj niektoré organizmy, ktoré v súčasnosti existujú. Za týchto podmienok sa tieto procesy dosahujú jednoduchými mechanizmami šírenia, pretože bunková stena je v intímnom kontakte s médiom, ktoré ho dodáva.
 Krivka disociácie oxihemoglobínu (zdroj: ratznium v anglických verziách Wikipedialat bol nahraný Aaronsharpe na in.Wikipedia. [Verejná doména] cez Wikimedia Commons)
Krivka disociácie oxihemoglobínu (zdroj: ratznium v anglických verziách Wikipedialat bol nahraný Aaronsharpe na in.Wikipedia. [Verejná doména] cez Wikimedia Commons) Vývoj čoraz komplexnejších pluricelulárnych organizmov naznačoval, že vnútorné bunky sa značne presunuli od prostredia, takže mechanizmy šírenia, keď sa jediný zdroj dodávky stal nedostatočným.
Takto boli vyvinuté špecializované systémy na získanie živín a plynov, ako je tráviaci systém a respiračný systém, ako aj transportné mechanizmy na privedenie týchto živín a plynov do bunky: kardiovaskulárny systém.
Na výrobu energie vo forme molekúl ATP, bunky potrebujú kyslík. Vzhľadom na skutočnosť, že ATP sa nedá skladovať, musí byť neustále syntetizovaný, čo znamená trvalý dopyt po kyslíku bunkami.
Hemoglobín sa objavil, evolučne povedané, ako transportér plynu, ktorý „rieši“ problém transportu kyslíka z prostredia do bunky.
[TOC]
Vlastnosti
Ak chcete hovoriť o charakteristikách a štruktúre oxyhemoglobínu, je potrebné odkazovať na hemoglobín, pretože oxyhemoglobín nie je ničím iným ako kyslíkový hemoglobín. Preto sa odteraz opísajú charakteristiky kĺbov molekuly v prítomnosti alebo nie o príslušnom plyne.
Čo je hemoglobín pre?
Hemoglobín je potrebný na prepravu kyslíka do tkanív v množstve a rýchlosti, ktoré si zaslúžia, vzhľadom na skutočnosť, že kyslík má tak malú rozpustnosť v krvi, že jeho difúzny transport by nebol nedostatočný na dodávanie potrieb tkaniva.
Môže vám slúžiť: Dôkazy vývoja živých bytostíAká je molekula hemoglobínu?
Hemoglobín je tetramerický proteín (ktorý má štyri podjednotky), má sférický tvar a molekulárnu hmotnosť 64 kDa.
Jeho štyri podjednotky tvoria jednu funkčnú jednotku, kde každá recipročne ovplyvňuje druhú. Každá podjednotka sa skladá z polypeptidového reťazca, globínu a protetickej skupiny, skupiny Hemo alebo „Hem“, ktorá pôsobí ako kofaktor a nie je tvorená aminokyselinami; to znamená, že to nie je proteínová povaha.
Globin je dvoma spôsobmi: alfa globín a beta globín. Tetramér hemoglobínu pozostáva z páru alfa globínových reťazcov (141 aminokyselín) a niekoľkých beta globínových reťazcov (146 aminokyselín).
Každý zo štyroch reťazcov polypeptidov je spojený so skupinou Hemo, ktorá má atóm železa v železnom stave (FE2+) v strede.
Aká je skupina Hemo?
Skupina hemo je porfyrínový kruh, ktorý je tvorený štyrmi pyrolovými krúžkami (heterocyklické aromatické zlúčeniny s vzorcom C4H5N) spojené metylovými mostmi. Železo v železnom štáte nachádzajúci sa v strede podlieha štruktúre prostredníctvom koordinovaných dusíkových väzieb.
Každá skupina Hemo je schopná pripojiť sa k molekule kyslíka, takže každá molekula hemoglobínu môže spojiť iba 4 molekuly plynu 4 plynmi.
Ľudské telo obsahuje približne 2,5 x 1013 erytrocytov, ktoré sú krvné bunky, ktoré produkujú a transportujú hemoglobín. Každý erytrocyt má asi 280 miliónov molekúl hemoglobínu a potom môže transportovať viac ako 1 000 miliónov molekúl kyslíka.
Môže vám slúžiť: Hominizačný proces: Charakteristiky a fázyAko sa tvorí oxyhemoglobín?
Oxihemoglobín sa tvorí po spojení atómu kyslíka na každý atóm železa, ktorý sa nachádza v každej hemo skupine molekuly hemoglobínu.
Termín oxihemoglobín sa potom týka okysličeného a nie chemicky oxidovaného hemoglobínu, pretože nestráca elektrón v kombinácii s kyslíkom a železom zostáva v železnom stave.
Oxygenácia vytvára zmenu v kvartérnej štruktúre molekuly, to znamená zmenu konformácie, ktorá sa môže prenášať z globínových reťazcov do skupiny Hemmo a naopak.
Aké je maximálne množstvo kyslíka, ktoré dokáže načítať hemoglobín?
Hemoglobín sa môže vo svojej štruktúre pripojiť nanajvýš štyri kyslíkové molekuly. Ak je molárny objem ideálnych plynov 22.4 l/mol, jeden mol hemoglobínu (64.500 g) sa spojí s 89.6 litrov kyslíka (4 móly O2 x 22.4 l/mol).
Takže každý gram hemoglobínu sa musí pripojiť 1.39 ml O2, ktorá bude 100% nasýtená (89.6L/64500G X (1000 ml/l)).
V praxi krvné testy vykazujú mierne nižšie výsledky, pretože existujú malé množstvá methemoglobínu (oxidovaný hemoglobín) a karboxyhemoglobín (hemoglobín + oxid uhoľnatý (CO)), ktoré sa nemôžu spojiť s kyslíkom.
Berúc do úvahy toto pravidlo „Hüfner“ uvádza, že v krvi má 1 g hemoglobínu maximálnu kapacitu na zjednotenie kyslíka 1.34 ml.
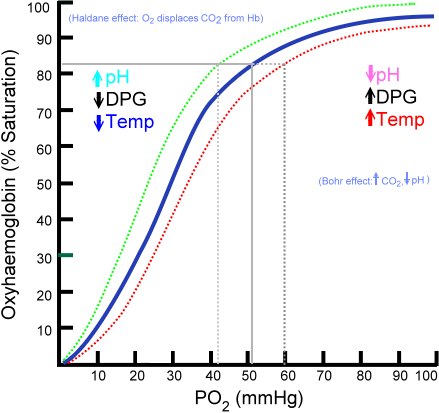
Krivka väzby oxyhemoglobínu
Množstvo molekúl kyslíka, ktoré sa môžu pripojiť k molekule hemoglobínu, závisí od čiastočného tlaku kyslíka alebo PO2. V neprítomnosti kyslíka sa hemoglobín deoxygenuje, ale ako sa zvyšuje PO2, počet kyslíka, ktorý sa viaže na hemoglobín, sa zvyšuje.
Proces väzby kyslíka na hemoglobín v závislosti od čiastočného tlaku kyslíka. Pri grafe sa výsledok nazýva „oxemoglobínová krivka“ a má charakteristickú formu „s“ alebo sigmoidu.
Môže vám slúžiť: TaxizmusV závislosti od PO2 bude hemoglobín v menšej alebo väčšej schopnosti „uvoľňovať“ alebo „dodať“ kyslík, ktorý transportuje, ako aj načítanie s tým.
Napríklad v regióne medzi 10 a 60 mmHg tlaku získate časť s väčším počtom krivky. V tomto stave môže hemoglobín ľahko poskytnúť veľké množstvo O2. Toto je stav, ktorý sa dosahuje v tkanivách.
Keď je PO2 medzi 90 a 100 mmHg (12 až 13 kPa), hemoglobín je takmer 100% nasýtený O2; A keď je arteriálny PO2 60 mmHg (8 kPa), saturácia s O2 je stále vysoká ako 90%.
V pľúcach to sú podmienky, ktoré prevládajú (tlak medzi 60 a 100 mmHg), a to je to, čo umožňuje molekuly hemoglobínu prítomné v erytrocytoch, aby sa naložili kyslík kyslíkom.
Táto sigmoidná forma, ktorá kreslí oxihemoglobínovú krivku požadovať.
Odkazy
- Líška, s. Jo. (2006). Human Physiology 9. vydanie (PP. 501-502). McGraw-Hill Press, New York, USA.
- Murray, r. Klimatizovať., Granner, D. Klimatizovať., Mayes, P. Do., & Rodwell, V. W. (2014). Harperova ilustrovaná biochémia. McGraw-Hill.
- Rawn, J. D. (1998). Biochemistry (1989). Burlington, Severná Karolína: Publishers Neil Patterson (c) n. Lalioti, CP Raptopoulou, a. Terzis, a. Panagiotopoulos, SP perlepes a. Maness-Zouopa, J. Chem. SOC. Dalton Trans, 1327.
- Robert M. Berne, Matthew N. Vyberať. (2001) Fyziológia. (3. ED.) Harcourt Editions, s.Do.
- West, J. B. (1991). Fyziologický základ lekárskej praxe. Williams a Wilkins
- « Charakteristiky erytropoietínu (EPO), výroba, funkcie
- Charakteristiky dystrofínu, štruktúra a funkcie »

