Charakteristiky oxidorreduktáz, štruktúra, funkcie, príklady
- 2704
- 116
- Gabriel Bahna
Ten oxidorreduktázy Sú to proteín s enzymatickou aktivitou, ktoré majú nabíjanie katalyzujúcich reakcií redukcie hrdze, to znamená reakcie, ktoré naznačujú odstránenie atómov vodíka alebo elektrónov v substrátoch, na ktorých pôsobia.
Reakcie katalyzované týmito enzýmami, ako už názov napovedá, sú reakcie oxidu, tj reakcie, kde molekula daruje elektróny alebo atómy vodíka a iná ich prijíma, čím sa mení svoje príslušné oxidačné stavy.
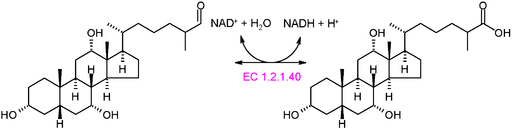 Grafická schéma reakcie oxidortázy typu EC 1.2.1.40 (Zdroj: Akane700 [CC By-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Via Wikimedia Commons)
Grafická schéma reakcie oxidortázy typu EC 1.2.1.40 (Zdroj: Akane700 [CC By-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Via Wikimedia Commons) Príkladom veľmi častých oxidortických enzýmov v prírode je enzény dehydrogenáz a oxidáz. Dalo by sa to spomenúť na enzým alkohol dehydrogenázy, ktorý katalyzuje dehydrogenáciu etanolu, aby sa vytvoril acetaldehyd v NAD+ závislých alebo reverznej reakcii, aby sa vytvoril etanol počas alkoholovej fermentácie vykonávanej niektorými komerčne dôležitými kvasinkami.
Enzýmy elektrónového dopravného reťazca v aeróbnych bunkách sú oxidorty zodpovedné za čerpanie protónov, takže generujú elektrochemický gradient cez vnútornú mitochondriálnu membránu, ktorá umožňuje zvýšiť syntézu ATPPPP.
[TOC]
Všeobecné charakteristiky
Oxidoreduktázové enzýmy sú enzýmy, ktoré katalyzujú oxidáciu zlúčeniny a súbežnú redukciu iného.
Zvyčajne si vyžadujú prítomnosť rôznych typov koenzýmov na ich prevádzku. Coenzýmy plnia funkciu darovania alebo akceptovania.
Tieto koenzýmy môžu byť moment NAD+/NADH TORUS alebo FAD/FADH2. V mnohých aeróbnych metabolických systémoch sa tieto elektróny a atómy vodíka nakoniec prenášajú z koenzýmov zapojených do kyslíka.
Sú to enzýmy s výrazným „nedostatkom“ špecifickosti substrátu, čo im umožňuje katalyzovať krížové reakcie v rôznych typoch polymérov, či už ide o bielkoviny alebo uhľohydráty.
Klasifikácia
Nomenklatúra a klasifikácia týchto enzýmov sú mnohokrát založené na hlavnom substráte, ktorý používajú, a typu koenzýmu, ktorý potrebujú na fungovanie.
Podľa odporúčaní Výboru pre nomenklatúru Medzinárodnej únie pre biochémiu a molekulárnu biológiu (NC-IBMB) tieto enzýmy patria do triedy E.C. 1 a zahrňte viac alebo menej 23 rôznych typov (e.C.1.1-e.C.1.23), ktoré sú:
Môže vám slúžiť: erytropoetín (EPO): Charakteristiky, výroba, funkcie- A.C. 1.1: ktoré konajú v skupinách CH-OH.
- A.C. 1.2: ktoré pôsobia v skupine Aldehyd Group alebo v skupine Oxo de Los Donor Group.
- A.C. 1.3: ktoré konajú v skupinách CH-CH.
- A.C. 1.4: Ktoré pôsobia v skupinách darcov CH-NH2.
- A.C. 1.5: Ktoré pôsobia v skupinách darcov CH-NH.
- A.C. 1.6: Ktoré pôsobia v Nadh alebo Nadph.
- A.C. 1.7: ktoré pôsobia na iné zlúčeniny dusíka, ako sú darcovia.
- A.C. 1.8: ktoré konajú v skupinách sír.
- A.C. 1.9: ktoré pôsobia v hemmo skupinách darcov.
- A.C. 1.10: ktoré konajú u darcov, ako sú difenoly a ďalšie súvisiace látky.
- A.C. 1.11: Ktoré pôsobia na peroxid ako akceptor.
- A.C. 1.12: ktoré pôsobia na vodík ako darca.
- A.C. 1.13: ktoré pôsobia na jednoduchých darcov so začlenením molekulárneho kyslíka (oxygenázy).
- A.C. 1.14: ktoré pôsobia na „spárovaných“ darcov, so začlenením alebo redukciou molekulárneho kyslíka.
- A.C. 1.15: ktoré pôsobia na superoxidy ako akceptory.
- A.C. 1.16: Ktoré oxidujú kovové ióny.
- A.C. 1.17: Ktorý koná v skupinách CH2.
- A.C. 1.18: ktoré pôsobia na proteíny, ktoré obsahujú železo a predpokladajú sa ako darcovia.
- A.C. 1.19: ktoré pôsobia na zníženie flavodoxínu ako darcu.
- A.C. 1.20: ktoré pôsobia na darcov ako fosfor a arzén.
- A.C. 1.21: ktoré pôsobia v reakcii x-h + y-h = x-y.
- A.C. 1.22: Ktoré pôsobia na halogén darcov.
- A.C. 1.23: ktoré znižujú skupiny C-O-C ako akceptorov.
- A.C. 1.97: Ostatné oxidoryductázy.
Každá z týchto kategórií obsahuje aj podskupiny, v ktorých sú enzýmy oddelené podľa preferencie substrátov.
Môže vám slúžiť: Primárna sukcesia: Charakteristiky a príkladyNapríklad v skupine oxidoreduktáz, ktoré pôsobia na skupiny CH-OH ich darcov, sú niektoré, ktoré uprednostňujú NAD+ alebo NADP+ ako akceptory, zatiaľ čo iní používajú cytochrómy, kyslík, síru atď.
Štruktúra
Pretože skupina oxidoreduktáz je mimoriadne rozmanitá, stanovenie definovanej štrukturálnej charakteristiky je dosť komplikované. Jeho štruktúra sa mení nielen od enzýmu k enzýmu, ale aj medzi druhmi alebo skupinou živých bytostí a dokonca aj bunkami k bunkám v rôznych tkanivách.
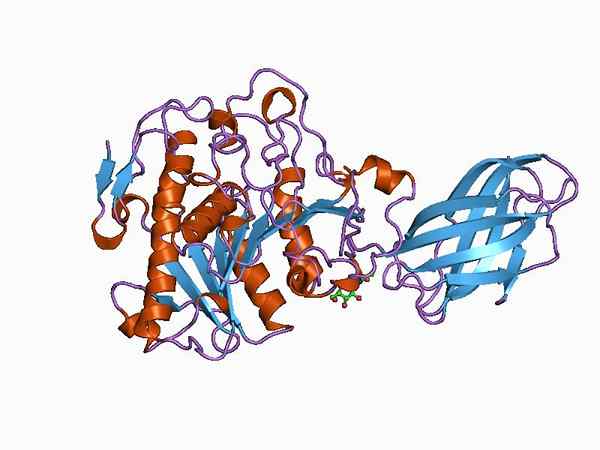
 Bioinformatický model štruktúry enzýmu oxyductázy (zdroj: Jawahar Swaminathan a personál MSD v Európskom bioinformatickom inštitúte [verejná doména] prostredníctvom Wikimedia Commons)
Bioinformatický model štruktúry enzýmu oxyductázy (zdroj: Jawahar Swaminathan a personál MSD v Európskom bioinformatickom inštitúte [verejná doména] prostredníctvom Wikimedia Commons) Napríklad enzým pyruvátdehydrogenáza je komplex zložený z troch sekvenčne prepojených katalytických podjednotiek a známych ako podjednotka E1 (dehydrogenáza piruvát), podjednotiny E2 (dihydrogenipamid) a podjednotkov Dihydrolipamidu (dihydrogén) (dihydrogénne) (dihydrogén) (dihydrolipamid).
Každá z týchto podjednotiek môže byť zase zložená z viac ako jedného proteínového monoméru toho istého typu alebo rôznych typov, to znamená, že môžu byť homodimérne (tie, ktoré majú iba dva rovnaké monoméry), heterotrimérica (ktoré majú tri monoméry odlišné) a tak ďalej.
Zvyčajne sú to však enzýmy zložené z alfa haly a β-patovaných listov usporiadaných v rôznych formách, so špecifickými intermolekulárnymi interakciami rôznych typov rôznych typov.
Funkcia
Oxidortované enzýmy katalyzujú reakcie oxidu redukcie prakticky vo všetkých bunkách všetkých živých bytostí na biosfére. Tieto reakcie sú všeobecne reverzibilné, v ktorých sa mení oxidačný stav jedného alebo viacerých atómov v tej istej molekule.
Oxidorestóny zvyčajne potrebujú dva substráty, jeden, ktorý pôsobí ako darca vodíka alebo elektrónov (ktorý oxiduje) a druhý, ktorý pôsobí ako akceptor vodíka alebo elektrónov (čo je znížené).
Tieto enzýmy sú mimoriadne dôležité pre mnoho biologických procesov v rôznych typoch buniek a organizmov.
Pracujú napríklad pri syntéze melanínu (pigment, ktorý sa tvorí v bunkách kože ľudí), pri tvorbe a degradácii lignínu (štrukturálna zlúčenina rastlinných buniek), pri skladaní proteínov atď.
Môže vám slúžiť: Druhy predstavené na Galapágových ostrovochPriemyselne sa používajú na modifikáciu textúry niektorých potravín a príkladmi sú peroxidázy, oxidázová glukóza a ďalšie.
Okrem toho najvýznamnejšími enzýmami tejto skupiny sú tie, ktoré sa zúčastňujú ako elektronické transportéry v dopravníkových reťazcoch mitochondriálnej membrány, chloroplastov a vnútornej plazmatickej membrány baktérií, kde sú to transmembranálne proteíny.
Príklady oxidortov
Existujú stovky príkladov oxidovaných enzýmov v prírode a priemysle. Tieto enzýmy, ako už bolo spomenuté, majú funkcie nanajvýš dôležitosti pre bunkové fungovanie, a teda aj pre život samy.
Oxididuktázy zahŕňajú nielen enzýmy peroxidázy, lakquery, glukózu oxidázy alebo dehydrogénny alkohol; Kombinujú tiež dôležité komplexy, ako je glyceraldehyd enzým 3-fosfát dehydrogenáza alebo komplimenus dehydrogenáza, atď., nevyhnutné z hľadiska glukózového katabolizmu.
Zahŕňa tiež všetky enzýmy elektronického transportného komplexu vo vnútornej mitochondriálnej membráne alebo do vnútornej membrány baktérií, podobne ako niektoré enzýmy nachádzajúce sa v chloroplastoch rastlinných organizmov.
Peroxidázy
Peroxidázy sú veľmi rozmanité enzýmy a používajú peroxid vodíka ako akceptor elektrónov na katalyzáciu oxidácie rôznych substrátov vrátane fenolov, amínov alebo tiol. Vo svojich reakciách znižujú peroxid vodíka, kým nevytvorí vodu.
Sú veľmi dôležité z priemyselného hľadiska, pretože peroxidáza pikantnej reďkovky.
Biologicky povedané, peroxidázy sú dôležité pre elimináciu zlúčenín kyslíka činidla, ktoré môžu spôsobiť významné poškodenie buniek.
Odkazy
- Encyclopaedia Britannica. (2019). Získané 26. decembra 2019, z www.Britannica.com
- Ercili-Cura, D., Hupperz, T., & Kelly, a. L. (2015). Enzymatická modifikácia textúry mliekarenského produktu. Pri modifikácii textúry potravín (str. 71-97). Vydavateľstvo.
- Mathews, C. Klimatizovať., Van Holde, K. A., & Ahern, K. G. (2000). Biochémia. Pridať. Wesley Longman, San Francisco.
- Nelson, D. L., Lehninger, a. L., & Cox, M. M. (2008). Lehninger princípy biochémie. Macmillan.
- Výbor pre nomenklatúru Medzinárodnej únie biochémie a molekulárnej biológie (NC-IBMB). (2019). Zdroj z www.Qmul.Ac.UK/SBCS/IUBMB/ENZYME/INDEX.Html
- Patel, m. Siež., Nemeria, n. Siež., Furey, w., & Jordan, f. (2014). Komplexy pyruvátu dehydrogenázy: funkcia a regulácia štruktúry a základne. Journal of Biological Chemistry, 289 (24), 16615-16623.

