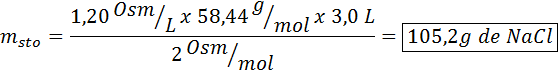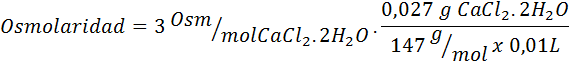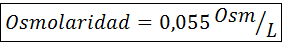Osmolarita
- 5001
- 1324
- Václav Višňovský
Čo je osmolarita?
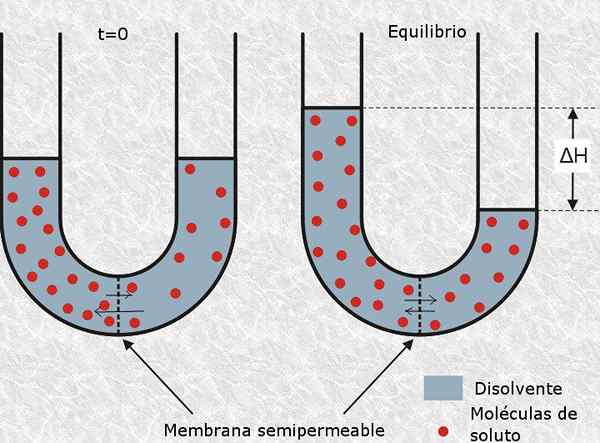
Ten Osmolarita Je to koncentračná jednotka, ktorá označuje molárnu koncentráciu súboru osmoticky aktívnych častíc prítomných v roztoku. Inými slovami, osmolarita je molarita osmoticky aktívnych častíc.
je definovaný ako osmoticky aktívna častica K tejto neutrálnej alebo iónovej molekule, ktorá nemôže prekročiť semipermaktívnu membránu, ako je bunková membrána. Prítomnosť tohto typu častíc vytvára osmotický tlak v roztoku, a tým aj jeho názov.
Počet mólov osmoticky aktívnych častíc sa nazýva Osmoly (reprezentované symbolom OSM), takže osmolarita je vyjadrená v jednotkách OSM/L.
Dôležitosť osmolarity
Osmolarita je koncept veľkej dôležitosti pre biológiu a medicínu, pretože osmotická rovnováha buniek s ich prostredím je nevyhnutná pre ich prežitie. Napríklad injekcia roztoku s veľmi vysokou alebo veľmi nízkou osmolaritou intravenózne môže pacientovi ľahko spôsobiť smrť.
 Osmolarita je nevyhnutným aspektom riešení v medicíne a biológii
Osmolarita je nevyhnutným aspektom riešení v medicíne a biológii Na druhej strane, veľmi bežnou technikou, ktorú bunkoví biológovia používajú na prelomenie buniek rôznych typov, je prostredníctvom osmotickej lýzy. To spočíva v umiestňovaní buniek do hypotonického roztoku (s veľmi nízkou osmolaritou), takže voda roztoku ich preniká osmózou a praskne ich.
Vďaka tomu je veľmi dôležité pre lekárov, ako aj pre biológov a odborníkov z iných oblastí, poznať, merať alebo vedieť, ako vypočítať osmolaritu riešenia.
Môže vám slúžiť: Percentuálna koncentráciaRozdiely medzi osmolaritou a osmolalitou
Keď hovoríme o osmolarite, je tiež potrebné hovoriť o osmolalite. Osmolalita je podobná osmolarite, rovnakým spôsobom, ako je morálka podobná molarite.
Zatiaľ čo osmolarita označuje Počet osmolov na liter roztoku (OSM/L), Osmolalita označuje to isté, ale Pre každý kilogram rozpúšťadla (OSM/kg).
Osmolalita má tú výhodu, že v závislosti od objemu roztoku, ani nezávisí od hustoty alebo teploty. Z tohto dôvodu bude mať roztok rovnakú osmolalitu pri 25 ° C ako pri 37 ° C. Na druhej strane, jej osmolarita 37 ° C bude o niečo nižšia ako jej osmolarita pri 25 ° C, v dôsledku zvýšenia objemu tepelnej expanzie.
Osmolarita sa zvyčajne ľahšie merám experimentálne ako osmolarita. Osmolarita sa však ľahšie vypočítava a je ľahšie pracovať, keď sa pripravuje riedenie.
Ako sa vypočíta osmolarita roztoku?
Existuje niekoľko spôsobov, ako vypočítať osmolaritu riešenia, v závislosti od spočítaných informácií. Dá sa vypočítať z:
- Množstvá rozpustenej látky a roztoku.
- Molarita prítomných rozpustených látok.
- Jednotlivé koncentrácie iónov.
- Percentuálny podiel m/v rozpustení, okrem iného.
Vo všetkých prípadoch je výpočet založený na všeobecnom vzorci osmolarity, ktorý je:

Kde nOSM Je to počet osmolov prítomných v roztoku a Vložkaslnko Je to objem toho istého vyjadreného v litroch. Počet osmolov sa vypočíta vynásobením počtu mólov v rozpustení počtom častíc, v ktorých sa disociuje v roztoku.
Môže vám slúžiť: heterogénne zmesi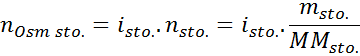
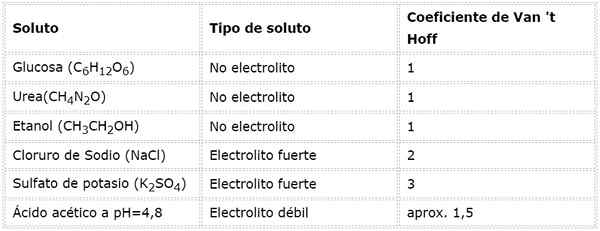
V tejto rovnici, nstopovať Je to počet mólov rozpustenej látky, mstopovať je jej hmota (v G), Mmstopovať Je to jeho molárna hmota (v G/mol) a Jostopovať Je to koeficient van 't hoff rozpustenej látky. Tento koeficient má hodnotu 1 pre neelektrolyty rozpustených látok (Napríklad glukóza).
Pre silné elektrolyty, ktoré sú úplne disociované (ako je chlorid sodný, NaCl), sa koeficient van 't hoff sa rovná celkovému počtu iónov, v ktorých každý mol zlúčeniny disociuje.
Napríklad v prípade síranu draselného, k2SW4, ktorej disociačná reakcia je:
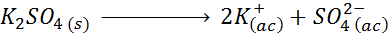
Každá mol soli, ktorá rozpúšťa, produkuje 3 móly iónov (2 K ióny+ A 1 ión42-), teda I = n = 3.
V prípade slabých elektrolytov je výpočet komplikovanejší, ale zvyčajne sa určujú experimentálne. Nasledujúca tabuľka sumarizuje koeficienty Van 't Hoff pre niektoré bežné rozpustené soluty.
Príklady výpočtu osmolarity
1. Príklad 1
Stanovte osmolaritu pripraveného roztoku rozpustením 10 g NaCl a 10 g glukózy v 100 ml roztoku
Riešenie: V tomto prípade sa osmoles každej rozpustenej látky vypočítajú osobitne a potom pridávajú. Molárne hmoty sú 58,45 g/mol a 180 g/mol a koeficienty VE 't hoff sú 2 a 1:
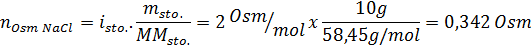
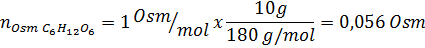
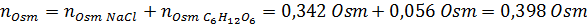
Teraz vypočítame osmolaritu pomocou vzorca, pretože vieme, že 100 ml sa rovná 0,100L:
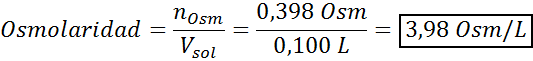
Nakoniec je osmolarita roztoku 3,98 OSM/L.
2. Príklad 2
Stanovte osmolaritu moláru sulfátu draselného sulfátu 0,05 roztoku.
Riešenie: Ak už poznáme molaritu rozpustenej látky, výpočet osmolarity je rovnako jednoduchý ako vynásobenie tejto koncentrácie van 't hoff faktorom.
Môže vám slúžiť: benzaldehyd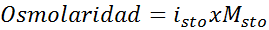
V tomto prípade je faktor soli 3.
3. Príklad 3
Stanovte osmolaritu vzorky plazmy obsahujúcej 0,125 M sodíkových iónov, 0,020 m draslíkových iónov a 0,145 chloridových iónov.
Riešenie: Osmolarita jednotlivých iónov sa rovná ich molarite, pretože ióny sa viac nerozlišujú a majú i = 1. Z tohto dôvodu je v tomto prípade potrebné iba vynásobiť I = 1 Každá koncentrácia a pridajte:
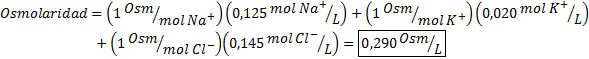
4. Príklad 4
Vypočítajte osmolaritu roztoku obsahujúceho 27 mg CAP2.2h2Alebo za každých 10 ml roztoku
Riešenie: Molekulová hmotnosť Cochl2.2h2Alebo je to 147 g/mol. Pri rozpustení sa táto soľ rozdelí na 2 molekuly vody a tri ióny. Molekuly vody však nie sú osmoticky aktívnymi časticami, takže sa nezohľadňujú pri výpočte osmolarity a koeficient pre túto zlúčeninu je 3.

5. Príklad 5
Aká hmotnosť chloridu sodného je potrebná na prípravu 3 litrov roztoku, ktorého osmolarita je 1,20 osm/l?
Riešenie: V tomto prípade, keď sa požaduje hmotnosť rozpustenej látky a máme objem a koncentráciu, stačí na vyčistenie hmotnosti vzorca osmolarity.