Spektrálny zápis

- 3262
- 983
- Adrián Fajnor
 Tabuľka, ktorá označuje úrovne a orbitály
Tabuľka, ktorá označuje úrovne a orbitály Čo je spektrálna notácia?
Ten Spektrálny zápis Je to usporiadanie elektrónov na hladinách energie okolo jadra atómu. Podľa starej atómovej modelu Bohra elektróny zaberajú niekoľko úrovní v obežných dráhach okolo jadra, prvej vrstvy najbližšie k jadru k siedmej vrstve, Q, ktorá je najvzdialenejšia od jadra.
Pokiaľ ide o rafinovanejší kvantový mechanický model, vrstvy K-Q sú rozdelené do sady orbitálov, z ktorých každý môže byť obsadený nie viac ako niekoľkými elektrónmi.
Elektronická konfigurácia sa bežne používa na opis orbitálov atómu v jeho základnom stave, ale môže sa tiež použiť na reprezentáciu atómu, ktorý bol ionizovaný v katióne alebo aninii, a kompenzuje stratu alebo zisk elektrónov v ich príslušných orbitáloch.
Mnoho fyzikálnych a chemických vlastností prvkov môže korelovať s ich jedinečnými elektronickými konfiguráciami. Elektróny Valencia, elektróny vo vonkajšej vrstve, sú určujúcim faktorom pre jedinečnú chémiu prvku.
Keď elektróny najvzdialenejšej vrstvy atómu prijímajú energiu z nejakého druhu, presúvajú sa k väčším energetickým vrstvám. Elektrón vo vrstve K sa teda prenesie do vrstvy L v stave najväčšej energie.
Keď sa elektrón vráti do svojho základného stavu, uvoľní energiu, ktorú absorbuje emitentom elektromagnetického spektra (svetlo). Pretože každý atóm má špecifickú elektronickú konfiguráciu, bude mať tiež špecifické spektrum, ktoré sa bude nazývať absorpčné (alebo emisné) spektrum.
Z tohto dôvodu sa pojem spektrálny zápis používa na označenie elektronickej konfigurácie.
Ako určiť spektrálnu notáciu: kvantové čísla
Na úplné opísanie pohybu a trajektórií každého elektrónu vo vnútri atómu sa používajú celkom štyri kvantové čísla.
Kombinácia všetkých kvantových čísel všetkých elektrónov v atóme je opísaná vlnovou funkciou, ktorá spĺňa Schrödingerovu rovnicu. Každý elektrón v atóme má jedinečnú sadu kvantových čísel.
Môže vám slúžiť: Molárna frakcia: Ako sa vypočítava, príklady, cvičeniaPodľa princípu vylúčenia Pauliho nemôžu dva elektróny zdieľať rovnakú kombináciu štyroch kvantových čísel.
Kvantové čísla sú dôležité, pretože sa môžu použiť na určenie elektronickej konfigurácie atómu a pravdepodobnej polohy atómových elektrónov.
Kvantové čísla sa tiež používajú na určenie ďalších charakteristík atómov, ako je ionizačná energia a atómový polomer.
Kvantové čísla označujú špecifické škrupiny, čiastky, orbitály a elektróny.
To znamená, že úplne opisujú charakteristiky elektrónu v atóme, to znamená, že opisujú každé jedno riešenie pre Schrödingerovu rovnicu alebo vlnovú funkciu elektróny v atóme.
Existuje celkom štyri kvantové čísla: hlavné kvantové číslo (n), kvantové číslo orbitálneho uhlového uhlu (L), magnetické kvantové číslo (ml) a kvantové číslo elektrónového spin (MS).
Hlavné kvantové číslo, NN, opisuje energiu elektrónu a najpravdepodobnejšiu vzdialenosť jadrového elektrónu. Inými slovami, vzťahuje sa na veľkosť orbitálu a úroveň energie, v ktorej je elektrón umiestnený.
Počet čiastkových subcaps alebo ll opisuje formu orbitálu. Môže sa tiež použiť na určenie počtu uhlových uzlov.
Magnetické kvantové číslo, ML, opisuje hladiny energie v čiastkovej farbe a ďalšie sa vzťahuje na rotáciu na elektróne, ktoré môže byť hore alebo dole.
Aufbau
Aufbau pochádza z nemeckého slova Aufbauen, Čo znamená „stavať“. Pri písaní elektrónových konfigurácií v podstate budujeme elektrónové orbitály, keď postupujeme z jedného atómu na druhý.
Keď píšeme elektronickú konfiguráciu atómu, vyplníme orbitály v rastúcom poradí atómového čísla.
Princíp AUFBAU pochádza zo princípu Pauliho vylúčenia, ktorý tvrdí, že v atóme nie sú dve fermiony (napríklad elektróny).
Môže vám slúžiť: kyselina maslová: vzorec, vlastnosti, riziká a použitiaMôžu mať rovnakú sadu kvantových čísel, takže musia „akumulovať“ pri vyšších úrovniach energie. Ako sa akumulujú elektróny, je témou nastavení elektrónov.
Stabilné atómy majú toľko elektrónov ako protóny v jadre. Elektróny sa zhromažďujú okolo jadra v kvantových orbitáloch podľa štyroch základných pravidiel nazývaných princíp AUFBAU.
1. V atóme nie sú žiadne dva elektróny, ktoré zdieľali rovnaké štyri kvantové čísla n, l, m a s.
2. Elektróny najprv zaberajú orbitály najnižšej energetickej úrovne.
3. Elektróny naplnia orbitály vždy rovnakým rotačným číslom. Keď sú orbitály plné, začne sa to.
4. Elektróny vyplnia orbitály pre súčet kvantových čísel n a l. Orbitály s rovnakými hodnotami (n + l) budú vyplnené najskôr s nižšími hodnotami N.
Druhé a štvrté pravidlá sú v podstate rovnaké. Príkladom štvrtého pravidla by boli Orbitals 2p a 3s.
Orbitál 2p je n = 2 a l = 2 a 3s orbitál je n = 3 a l = 1. (N + l) = 4 v obidvoch prípadoch, ale orbitál 2p má najnižšiu energiu alebo nižšiu hodnotu a bude vyplnený pred vrstvou 3s.
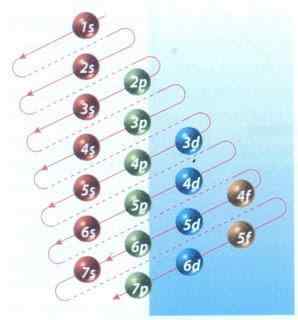 Obrázok 2: Moeller Diagram výplne elektronickej konfigurácie
Obrázok 2: Moeller Diagram výplne elektronickej konfigurácie Našťastie môžete na vyplnenie elektrónov použiť diagram Moeller znázornený na obrázku 2. Graf sa číta vykonaním diagonálov od 1 s.
Obrázok 2 zobrazuje atómové orbitály a šípky označujú spôsob sledovania.
Teraz, keď je známe, že poradie orbitálov je vyplnené, jediná vec, ktorá zostáva, je zapamätať si veľkosť každého orbitálu.
Orbitály majú 1 možnú hodnotu ml Obsahovať 2 elektróny
P orbitály majú 3 možné hodnoty ml Obsahovať 6 elektrónov
Orbitály majú 5 možných hodnôt ml Obsahovať 10 elektrónov
F Orbitals majú 7 možných hodnôtl Obsahovať 14 elektrónov
To je všetko, čo je potrebné na určenie elektronickej konfigurácie stabilného atómu prvku.
Môže vám slúžiť: Dodecil sulfát sodný (SDS): Štruktúra, vlastnosti, použitiaNapríklad vezmite dusíkový prvok. Dusík má sedem protónov, a preto sedem elektrónov. Prvým orbitálom, ktorý vyplní, je orbitál 1s. Orbitál má dva elektróny, takže zostáva päť elektrónov.
Ďalším orbitálom je orbitál 2S a obsahuje ďalšie dva. Tri konečné elektróny pôjdu na orbitál 2p, ktorý môže obsahovať až šesť elektrónov.
Pravidlá
Sekcia AUFBAU diskutovala o tom, ako elektróny vyplňujú najskôr orbitály s najnižšou energiou a potom sa presunú na orbitály s najvyššou energiou až po plných energetických orbitáloch.
S týmto pravidlom však existuje problém. Orbitály 1S určite musia byť vyplnené pred orbitami 2 s, pretože orbitály 1S majú nižšiu hodnotu N, a preto nižšiu energiu.
A tri rôzne orbitály? V akom poradí by mali byť vyplnené? Odpoveď na túto otázku zahŕňa pravidlo umývadla.
Pravidlo umývadla uvádza, že:
- Každý orbitál v podskupine je obsadený individuálne skôr, ako bude akýmkoľvek orbitálom dvojnásobne obsadený.
- Všetky elektróny na individuálne obsadených orbitáloch majú rovnaký zákrut (na maximalizáciu celkového otočenia).
Ak sú elektróny priradené k orbitálom, elektrón sa najprv snaží vyplniť všetky orbitály podobnou energiou (tiež nazývanou degenerovaný orbitály) pred porovnaním s iným elektrónom v polovici orbitálu.
Atómy v zemských štátoch majú tendenciu mať čo najviac elektrónov. Pri vizualizácii tohto procesu zvážte, ako elektróny vykazujú rovnaké správanie ako rovnaké póly v magnete, ak sa budú kontaktovať.
Keď negatívne nabité elektróny vyplňte orbitály, najprv sa pokúsia dostať preč, ako je to možné, skôr ako sa musia zhodovať.
Odkazy
- Kvantové čísla. Chémia obnovená.Librettexts.orgán.
- Elektrónové konfigurácie a vlastnosti atómov (s.F.). Zotavené z Oneonty.Edu.
- Elektronická konfigurácia. Zotavené z Britannice.com.

