Žiadna história kovov, vlastnosti, skupiny, použitie

- 4174
- 1071
- Denis Škriniar
Ten Žiadne kovy Sú to skupina prvkov, ktoré sa nachádzajú na pravej strane periodickej tabuľky, s výnimkou vodíka, ktorý sa nachádza v skupine 1 (AI), spolu s alkalickými kovmi. Ak chcete vedieť, čo sú, musíte sa pozrieť na pravý horný roh bloku P.
Atómy, ktoré nie sú kovové, sú relatívne malé a ich vonkajšia elektronická vrstva má zvýšený počet elektrónov. Medzi nemetalickými prvkami je možné nájsť tuhé látky, kvapaliny a plyny; Aj keď sú väčšinou v plynnom stave, niektoré z nich obohacujú atmosféru.
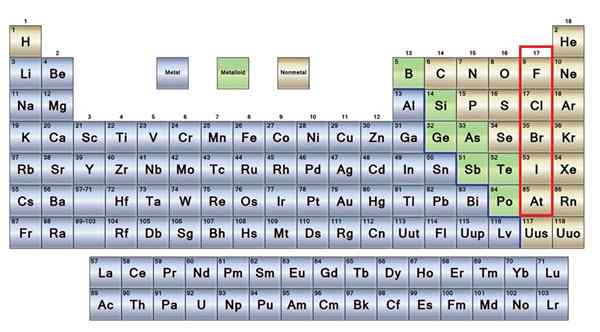 Nemetalické prvky v hnedej farbe
Nemetalické prvky v hnedej farbe Veľká časť non -metálov je prítomná u všetkých živých bytostí vo forme zlúčenín a makromolekúl. Napríklad: uhlík, kyslík a vodík sú prítomné vo všetkých proteínoch, lipidoch, uhľohydrátoch a nukleových kyselinách.
Fosfor je prítomný vo všetkých nukleových kyselinách a u niektorých uhľohydrátov a lipidov. Síra sa nachádza v mnohých proteínoch. Dusík je súčasťou všetkých nukleových kyselín a proteínov.
Na druhej strane, podzemné, metánové plyny a ropné suroviny sú takmer zložené z nemetalických prvkov. V skutočnosti uhľovodíky (uhlík a vodík) poskytujú predstavu o tom, ako hojné sú ne -metále napriek ich nižšiemu počtu prvkov v periodickej tabuľke.
[TOC]
História
Od staroveku (3750 do.C.) Egypťania použili uhlie na zníženie medi prítomného v mineráloch, ako sú Corvelita a Malachit.
V roku 1669 sa Brandovi Henninovi podarilo izolovať zhromaždený moč fosforu. Henry Cavendish (1776) dosiahol identifikáciu vodíka, hoci niekoľko vedcov, vrátane Roberta Boyla (1670), produkovalo vodík reagovaním na silnú kyselinu s kovom.
Carl Scheele produkoval kyslík zahrievaním oxidu ortuti s dusičnanmi (1771). Curtois sa podarilo izolovať jód, zatiaľ čo sa snažil pripraviť soľné riasy z morských rias (1811). BALARD a GMELIN izolovali BOME (1825).
V roku 1868 nezávislí Janssen a Lockger. Moissanovi sa podarilo izolovať fluorid (1886).
V roku 1894 Lord Rayleigh a Ramsey objavili Argona štúdiom dusíkových vlastností. Ramsay a Travers (1898) izolovali krypton, neón a xenón tekutého argónu, kryogénnou destiláciou vzduchu.
Fyzikálne a chemické vlastnosti
 Síra je jedným z najreprezentatívnejších nemetalických prvkov. Zdroj: Ben Mills Via Wikipedia.
Síra je jedným z najreprezentatívnejších nemetalických prvkov. Zdroj: Ben Mills Via Wikipedia. Fyzický
Niektoré z fyzikálnych vlastností non -metalov sú:
-Majú nízku elektrickú vodivosť, s výnimkou uhlíka vo forme grafitu, čo je dobrý vodič elektriny.
Môže vám slúžiť: Heptano (C7H16): Štruktúra, vlastnosti a použitia-Môžu sa vyskytovať pod fyzickým výskytom tuhých látok, kvapalín alebo plynov.
-Majú nízku tepelnú vodivosť, s výnimkou uhlíka vo forme diamantu, ktorý sa správa ako tepelný izolátor.
-Majú malý lesk, na rozdiel od kovového kovového jasu.
-Neovládne tuhé látky sú krehké, takže nie sú ťažkosti alebo poddajné.
-Majú nízke topiace sa a varné body.
-Môžu prezentovať rôzne kryštalické štruktúry. Fosfor, kyslík a fluorid majú teda kubickú kryštalickú štruktúru; Vodík, uhlík a dusík, hexagonálne; a síra, chlór, bróm a jód, Ortorrombic.
Chémia
Non kovy sa vyznačujú vysokou ionizačnou energiou a vysokou hodnotou elektronegativity. Napríklad fluór má najväčšiu elektronegativitu (3,98), ktorý je najreaktívnejším prvkom non -metálov.
Ale prekvapivo, hnusné plyny hélium (5,5) a neón (4,84) majú najväčšiu elektronegativitu. Sú však chemicky inertné na to, aby boli plné vonkajších elektronických vrstiev.
Non kovy tvoria iónové zlúčeniny s kovmi a kovalentné s non -metami.
Nemetalické prvky tvoria diatomické molekuly spojené kovalentnými väzbami. Medzitým sú atómy ušľachtilých plynov vo forme atómových jednotiek.
Vytvárajú kyslé oxidy, ktoré reagujú s vodou, vznikajú kyseliny.
Skupiny bez kovov a prvkov

Skupina 1
Je tvorený vodíkom bezfarebný a toaletný plyn, dialotomický. Oxidačný stav +1. Má menšiu hustotu ako vzduch. V pevnom stave predstavuje šesťuholníkovú kryštalickú štruktúru. Vodík je trochu reaktívny prvok.
Skupina 14
Uhlík je jediný net -metal patriaci tejto skupine. Uhlík vo forme grafitu je lesklá pevná látka so šesťuholníkovou kryštalickou štruktúrou. Má vysokú elektrickú vodivosť. Jeho najbežnejšie oxidačné stavy sú +2 a +4.
Skupina 15
Dusík
Bezfarebný a toaletný plyn. Je to trochu reaktívny prvok a mierne hustejší ako vzduch. Bežnejšie stavy oxidácie: -3 a +5. Formovať diatomické molekuly, n2.
Zápas
Pevná, jej farba môže byť biela, žltá alebo čierna. Malý reaktívny. Ortorrombická kryštalická štruktúra. Elektronegativita 2,1. Bežnejšie stavy oxidácie: -3 a +5.
Skupina 16
Kyslík
Bezfarebný plyn alebo bledomodré, toaleta. Všeobecne nie reaktívne. Kubická kryštalická štruktúra. Je to izolátor a silné oxidačné činidlo. Elektronegativita 3.5. Oxidačný stav -2
Síra
Jasne žltá pevná, krehká, mierne reaktívna. Ortorrombická kryštalická štruktúra. Tvoriť kovalentné väzby. Elektronegativita 2.5. Bežnejšie stavy oxidácie: -2, +2, +4 a +6.
Selén
Čierna šedá alebo červenkastá pevná látka. Šedý selén vykazuje elektrickú vodivosť citlivú na svetlo. Je to mäkká a krehká pevná látka. Elektronegativita 2.4. Oxidačné stavy: -2, +2, +4 a +6.
Môže vám slúžiť: hydroxid draselný: štruktúra, vlastnosti, použitiaSkupina 17
Fluór
Je to bledožltý plyn, veľmi toxický. Je to veľmi reaktívny prvok. Je prezentovaný ako diatomické molekuly, f2. V tuhom stave kryštalizuje v kubickej forme. Elektronegativita 3,98. Oxidačné stavy -1.
Chlór
Je to zelený žltý plyn. Predstavuje diatomické molekuly, CL2. Je to veľmi reaktívne. V tuhom stave je kryštalická štruktúra ortorrombická. Elektronegativita 3.0. Oxidačné stavy: - 1, +1, +3, +5, +7.
Bróm
Je to tekutina z červenej kaviarne. Elektronegativita 2.8. Oxidačné stavy -1, +1, +3, +5 a +7.
Jód
Je to čierna tuhá látka, že keď je sublimované, emituje fialovú paru. Ortorrombická kryštalická štruktúra. Kovové jodidy sú iónové. Elektronegativita 2.5. Oxidačné stavy: -1, +1, +3, +5, y +7.
Astata
Je to čierna pevná látka. Kubická kryštalická štruktúra sústredená na tvár. Elektronegativita 2,2. Je to slabé oxidačné činidlo.
Skupina 18
Hélium
Má vysokú tepelnú vodivosť. Elektronegativita 5.5. Je chemicky inertný a nie horľavý. Nízka hustota a vysoká plynulosť.
Neón
Vysoká chladiaca kapacita v kvapalnom stave. Elektronegativita 4.84. Je to najmenej reaktívne ušľachtilé plyny.
Argón
Je hustejší ako vzduch. Chemicky inertný. Elektronegativita 3.2.
Kryptón
Elektronegativita 2.94. Môže reagovať s fluoridom za vzniku kryptonového difluoridu (KRF2).
Xenón
Prechádza cez bariéru krvného mozgu. Reaguje na elektrický prúd, ktorý vyrába svetlo. Elektronegativita 2,2. Komplexná forma s fluórom, zlatom a kyslíkom.
Radón
Je to rádioaktívny prvok. Elektronegativita 2.06. Formujte zlúčeniny s fluoridom (RNF2) a s kyslíkom (rno3).
Žiadosti
Vodík

Používa sa v raketovom pohone a ako palivo v motoroch automobilov, ktoré používajú vodík. Používa sa v syntéze amoniaku (NH3) a pri hydrogenácii tukov.
Uhlík
Graphit sa používa pri výrobe ceruziek a vlákien s vysokou rezistenciou, ktoré sa používajú pri vypracovaní športových článkov. Diamant sa používa ako klenot veľkej hodnoty a vo vŕtacích cvičeniach. Oxid uhličitý sa používa pri vypracovaní nealkoholických nápojov.
Dusík
Používa sa na výrobu amoniaku, kyseliny dusičnej a močoviny. Dusík je nevyhnutným prvkom pre rastliny a používa sa vo výrobe hnojív.
Zápas
Biely fosfor sa používa ako ratide, insekticíd a v pyrotechnickom priemysle. Červený fosfor sa používa vo výrobe zápasov. Jeho zlúčeniny sa tiež používajú pri vypracovaní hnojív.
Kyslík
Kyslík sa používa pri vypracovaní ocele, plastov a textilu. Používa sa tiež v raketovej, kyslíkovej terapii a dýchacej pomoci v lietadlách, ponorkách a vesmírnych letoch.
Môže vám slúžiť: Erbio: Štruktúra, vlastnosti, získanie, použitieSíra
Používa sa ako surovina na výrobu kyseliny sírovej, strelného prachu a vo vulkanizácii gumov. Sírany sa používajú na bielenie papiera a fungicídov.
Selén
Používa sa na prepožičanie šarlatovej červenej sfarbenia do skla. Používa sa tiež na neutralizáciu zelenkavej nuansy produkovaného skleneným znečistením so zlúčeninami železa. Používa sa vo fotoelektrických bunkách s aplikáciou na dvere a výťahy.
Fluór

Pridáva sa do zubných krémov, aby sa zabránilo kazu. Fluorid vodíka sa používa ako surovina pre teflón. Monoatomický fluoror sa používa pri výrobe polovodičov.
Chlór
Používa sa v extrakčnej metalurgii a chlorácii uhľovodíkov na výrobu rôznych výrobkov, ako je PVC. Chlór sa používa v bielení dreva a textilnej buničiny. Používa sa tiež ako dezinfekčný prostriedok na vodu.
Bróm
Používa sa pri príprave strieborného bromidu na šošovky citlivé na svetlo a vo fotografických filmoch, ktoré sa tiež používa pri vypracovaní sedatívneho bromidu sodného a dibrometánu, zložky benzínu proti dĺžke.
Jód
Pridá sa jodid draselný (KI), aby sa zabránilo struhaniu štítnej žľazy. Jódová tinktúra sa používa ako antiseptický a germicid. Jód je súčasťou hormónov štítnej žľazy.
Hélium
Používa sa pri plnení horúcich vzduchových balónov a zmiešaná s kyslíkom na hlboké dýchanie. Používa sa na zvary v inertnej atmosfére a pomáha udržiavať veľmi nízke výskumné teploty.
Neón
V sklenených trubiach, ktoré sa rozsvietia na pôsobenie elektriny (neónové červené svetlá).
Argón
Používa sa na vytvorenie atmosféry na zváranie a pri vyplňovaní reflektorov žiarenia.
Xenón
Pri výrobe zábleskov veľkej intenzity v krátkodobej fotografickej výstave sa používa zmes xenónu a kryptonu.
Radón
Používa sa pri liečbe rakovinových nádorov rádioterapiou.
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Mathews, C. Klimatizovať., Van Holde, K. A. A Ahern, K. G. (2002). Biochémia. Tretia edícia. Upraviť. Pearson-Addison Wesley
- HelMestine, Anne Marie, PH.D. (6. októbra 2019). Aké sú vlastnosti neovládok? Zotavené z: Thoughtco.com
- Wikipedia. (2019). Nekovový. Zdroj: In.Wikipedia.orgán
- Redaktori Enyclopaedia Britannica. (5. apríla 2016). Nekovový. Encyclopædia Britannica. Získané z: Britannica.com
- Jose m. Gavira Vallejo. (27. januára 2016). Čo sú pneogény? A iCOSOGOS, kryštalácie, kalkogény .. ? Zdroj: Triplenlace.com

