Koordinačné číslo Čo je, výpočet, príklady

- 4835
- 1427
- Alan Milota
On Koordinačné číslo Je to množstvo atómov, iónov alebo molekúl, ktoré interagujú so stredom iónov a koordinačných zlúčenín. Tento koncept sa dá použiť aj na molekuly, pričom sa zohľadňuje, koľko atómov je navzájom prepojených namiesto počtu ich odkazov.
Toto číslo je dôležité, pretože definuje geometrie komplexov, hustoty ich materiálnych fáz a dokonca aj stereochemický (priestorový) charakter ich reaktivity. Na zjednodušenie ich definície sa považujú za suseda atómu, ktorý obklopuje konkrétne centrum.
 V oblasti mincí dokážeme oceniť, čo sa myslí podľa koordinačného čísla
V oblasti mincí dokážeme oceniť, čo sa myslí podľa koordinačného čísla Zoberme si napríklad podlahu zloženú z horných mincí obrazu. Všetky mince majú rovnakú veľkosť a ak je každá pozorovaná, je obklopená ďalšími šiestimi; to znamená, že majú šesť susedov, a preto koordinačné číslo (c.N.) Pre mince je 6. Rovnaká myšlienka sa teraz rozširuje na trojrozmerný priestor.
Ak sú ich rádiá nerovnaké, nie všetky budú mať rovnaké koordinačné číslo. Napríklad: Čím väčšia je mena, tým viac susedov bude schopná interagovať s väčším počtom mincí okolo nej. Opak sa stane s malými mincami.
[TOC]
Koncept koordinačného čísla
Vs iónové rádiá. Koordinačné číslo
Koordinačné číslo je počet najbližších susedov a ktorí v zásade interagujú priamo s centrom, ktoré je väčšinou kovovým iónom. Odložíme teda mince, aby sme namiesto toho zvážili gule.
Tento kovový ión mn+, kde n Rovná sa ako jeho oxidácia alebo číslo Valencie, interaguje s ostatnými susedmi (iónovými alebo molekulárnymi) nazývanými ligandami. Čím vyššie n (+2, +3, atď.), menší bude mn+ A preto budú ligandy nútené viac pristupovať k interakcii s Mn+.
Môže vám slúžiť: Butyrický tuk: získanie, typy, zloženie, použitia, výhodyNasledujúci obrázok ilustruje vyššie uvedené:
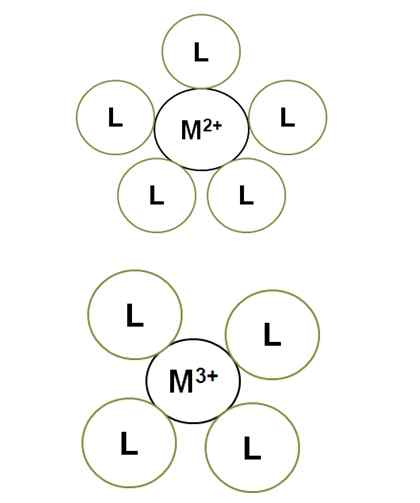 Variácia koordinačného čísla s zaťažením centrálneho iónu. Zdroj: Gabriel Bolívar.
Variácia koordinačného čísla s zaťažením centrálneho iónu. Zdroj: Gabriel Bolívar. M2+ V osvietenom komplexe má koordinačné číslo 5: je obklopený 5 ligandami l. Medzitým m3+ má 4 koordinačné číslo. Je to preto, že m3+, Za väčšiu veľkosť zaťaženia, jeho polomerov, a preto sa spojivá musia priblížiť viac, čo zvyšuje ich elektronické odpory.
Z tohto dôvodu F, alebo do druhého alebo tretieho obdobia bloku d, Majú tendenciu mať vyššie koordinačné čísla (C.N. > 6).
Hustota
Predpokladajme teraz, že m komplex3+ podstúpiť tlak. Bod príde tam, kde bude tlak taký, že iné spojenie je pravdepodobné koordinované alebo interakcie s M3+. To znamená, že jeho koordinačné číslo sa zvýši zo 4 na 5.
Všeobecne platí, že tlaky zvyšujú počet koordinácií, pretože susedia sa navzájom nútia na centrálny ión alebo atóm. V dôsledku toho sa materiálne fázy týchto látok stávajú hustejšou, kompaktnejšou.
Geometria
Vyššie ilustrácie nehovoria nič o geometriách okolo M2+ alebo m3+. Vieme však, že štvorec má štyri vrcholy alebo rohy, rovnako ako tetrahedron.
Toto zdôvodnenie sa dospelo k záveru, že geometria okolo m3+, ktorého c.N. Je to 4, musí byť štrbinovaný alebo štvorcový. Ale ktorý z nich? Medzitým geometrie pre m2+, ktorého c.N. Je 5, môže to byť štvorcová pyramída alebo trigonálna bipiramidálna.
Každý c.N. Spája niekoľko možných geometrií, ktoré umiestnia spojivá v priaznivej vzdialenosti, takže medzi nimi existuje najmenší odpor.
Môže vám slúžiť: interatomické odkazyAko sa vypočíta alebo určuje koordinačné číslo?
Koordinačné číslo je možné niekedy vypočítať priamo z príslušného zloženého vzorca. Predpokladajme aniónový komplex [Ni (CN)5]3-. Aké je koordinačné číslo pre nikel ión, alebo2+? Stačí pozorovať stechiometrický koeficient 5, čo naznačuje, že existuje 5 cn aniónov- koordinované alebo interakcie s centrom Ni2+.
Nie je to však vždy ľahké. Napríklad zlúčenina CUCN má koordinačné číslo 1 pre Cu2+ Pokiaľ ide o CN-. Skladá sa však z vlastne z polymérnych reťazcov CU-CN-CU-CN, takže správne koordinačné číslo je 2.
Preto je lepšie koordinačné číslo na jeho určenie namiesto jeho výpočtu. Ako? Stanovenie iónových alebo molekulárnych štruktúr zlúčenín. To je možné vďaka inštrumentálnym technikám, ako je napríklad difrakcia X -BAY, neutróny alebo elektróny.
Príklady koordinačných čísel
Ďalej a nakoniec sa uvedú niekoľko príkladov zlúčenín pre každé z najbežnejších čísel koordinácie. Podobne sa hovorí, aké sú ich príslušné geometrie.
C.N. 2
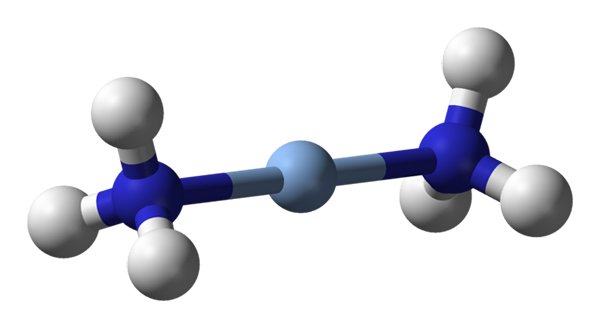 Tu sa pozoruje lineárna geometria [Ag (NH3) 2]+. Zdroj: Benjah-Bmm27 / verejná doména
Tu sa pozoruje lineárna geometria [Ag (NH3) 2]+. Zdroj: Benjah-Bmm27 / verejná doména A c.N. rovná 2 znamená, že centrálny atóm alebo ión majú iba dvoch susedov. Preto hovoríme o zlúčeninách povinných o lineárnych geometriách. Medzi nimi máme:
-Hg (ch3)2
-[AG (NH3)2]+
-PH3Balíček
C.N. 3
 Každý atóm uhlíka v tomto liste grafitu je spojený s ďalšími tromi, takže má troch susedov. Zdroj: Benjah-Bmm27 / verejná doména
Každý atóm uhlíka v tomto liste grafitu je spojený s ďalšími tromi, takže má troch susedov. Zdroj: Benjah-Bmm27 / verejná doména A c.N. rovná 3 znamená, že centrálny atóm alebo ión sú obklopené tromi susedmi. Potom máme geometrie, ako napríklad: trigonálna (trojuholníková) rovina, trigonálna pyramída a forma T. Príklady zlúčenín s týmto koordinačným číslom sú:
Môže vám slúžiť: atómová hmotnosť: definícia, typy, ako ho vypočítať, príklady-[Cu (CN)3]2-
-[PT (PCY3)3], Kde PCY odkazuje na ligand Tricylohexylopospine
-Grafit
C.N. 4
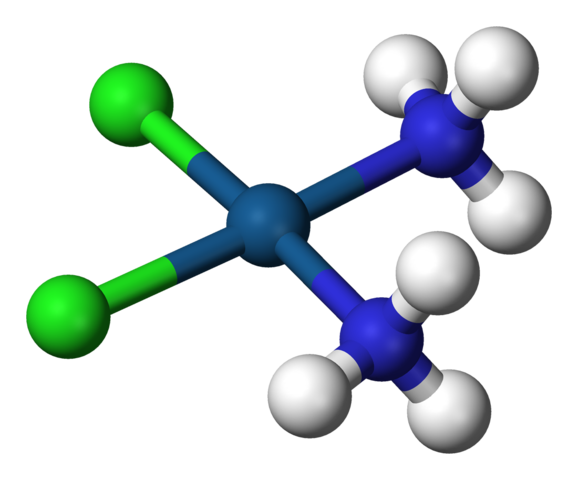 Štvorcová geometria cisplatiny, CIS-PTCL2 (NH3) 2. Zdroj: Benjah-Bmm27 / verejná doména
Štvorcová geometria cisplatiny, CIS-PTCL2 (NH3) 2. Zdroj: Benjah-Bmm27 / verejná doména A c.N. rovná 4 znamená, že centrálny atóm alebo ión sú obklopené štyrmi susedmi. Jeho možné geometrie sú tetraedrálne alebo štvorcové. Príklady zlúčenín s týmto koordinačným číslom majú nasledujúce:
-Chvály4
-Kokl2pych2
-Cis-ptcl2(NH3)2
-[Alcl4]-
-[Moo4]2-
-SNCL4
-[Cro4]2-
-[MNO4]2-
Všetky tieto príklady, s výnimkou CIS-PTCL2(NH3)2, Sú to tetraedrálne geometrie.
C.N. 5
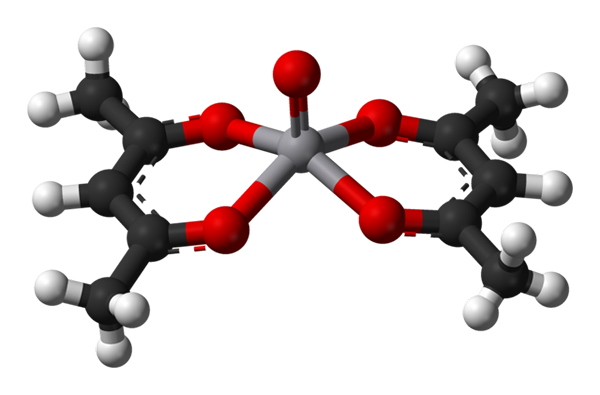 Štvorcová pyramídová geometria pre VO (ACAC) 2. Zdroj: Benjah-Bmm27 / verejná doména.
Štvorcová pyramídová geometria pre VO (ACAC) 2. Zdroj: Benjah-Bmm27 / verejná doména. A c.N. rovná 5 znamená, že atóm alebo centrálny ión sú koordinované alebo interagované s piatimi susedmi. Jeho geometrie, už spomínané, sú štvorcová pyramída alebo trigonálna bipiramidálna. Ako príklady máme:
-[Cobrn (ch2Chvály2Nme2)3]
-[Fe (CO)5]
-Vo (acac)2, ACAC je acetylacetonát ligand
C.N. 6
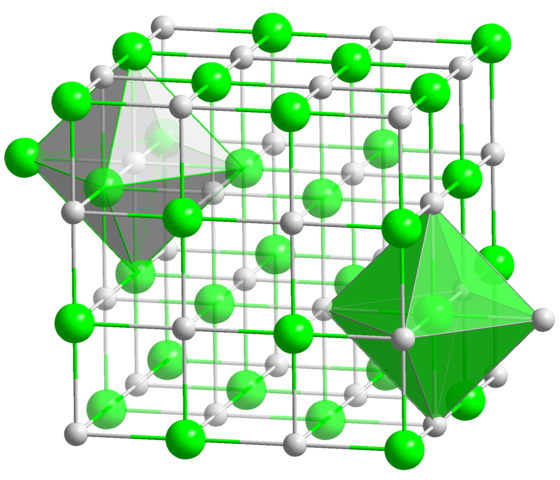 V kryštalickej štruktúre NaCl má každý na+ ión a cl- šesť susedov, takže toto je koordinačné číslo pre oba ióny (pozri oktaedra). Zdroj: Solid State / Public Domain
V kryštalickej štruktúre NaCl má každý na+ ión a cl- šesť susedov, takže toto je koordinačné číslo pre oba ióny (pozri oktaedra). Zdroj: Solid State / Public Domain Toto je zďaleka najbežnejšie koordinačné číslo medzi všetkými zlúčeninami. Nezabudnite na príklad princípových mincí. Ale namiesto jej obľúbenej geometrie je plochý šesťuholník, okrem trigonálneho hranolu, zodpovedá oktaedronu (normálny alebo zdeformovaný), okrem trigonálneho hranolu. Niektoré z mnohých príkladov zlúčenín s týmto koordinačným číslom sú:
-[Alf6]3-
-[CO (NH3)6]3+
-[ZR (vyberte si3)6]2-
-NaCl (áno, stolová soľ)
-Mos2, Všimnite si, že c.N. Pre túto zlúčeninu nie je 2
Ďalší
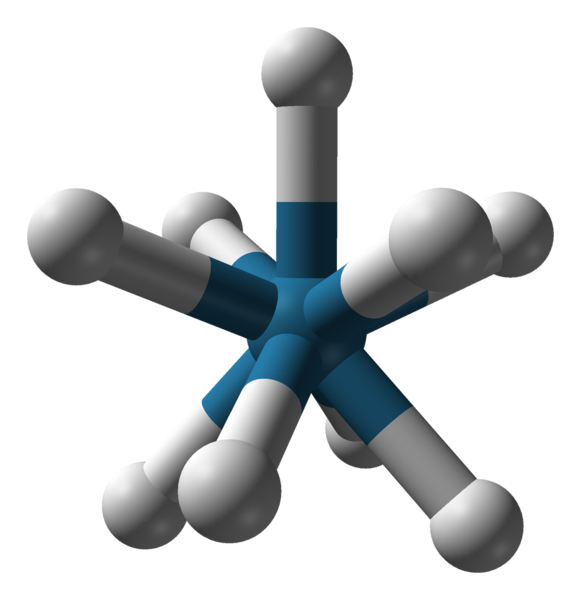 Tripaded Triapadic Prisma Geometria aniónu [reh9] 2-. Zdroj: Benjah-Bmm27 / verejná doména.
Tripaded Triapadic Prisma Geometria aniónu [reh9] 2-. Zdroj: Benjah-Bmm27 / verejná doména. Existujú aj ďalšie koordinačné čísla, od 7 do 15. Tak to c.N. Buďte vysokí, centrálny ión alebo atóm musia byť veľmi veľké, majú malé zaťaženie a zároveň musia byť ligandy veľmi malé. Niektoré príklady zlúčenín s takými C.N. Sú nižšie a na konci:
-Klimatizovať3[NBOF6], C.N. 7 a oktaedro geometria
-[MO (CN)8]3-
-[ZR (OX)4]2-, Byť oxalátom ligandu
-[Reh9]2-
-[Zamračené3)6]2-, C.N. rovná 12
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Wikipedia. (2020). Koordinačné číslo. Zdroj: In.Wikipedia.orgán
- Redaktori Enyclopaedia Britannica. (s.F.). Koordinačné číslo. Získané z: Britannica.com
- Profesor. Robert J. Lancashire. (15. augusta 2020). Koordinačné čísla a geometria. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- HelMestine, Anne Marie, PH.D. (28. augusta 2020). Definícia koordinácie v chémii. Zotavené z: Thoughtco.com

