Štruktúra draselného draselného (KNO2), vlastnosti a použitia

- 3933
- 573
- Mgr. Pravoslav Mokroš
On Dusitan draselný Je to anorganická soľ, ktorej chemický vzorec je ako2, ktorý je chemicky a farmakologicky príbuzný s dusičnanom draselným3. Jeho fyzický vzhľad pozostáva z žltkastných bielych kryštálov, vysoko hygroskopických, a preto vyhodenia; to znamená, že sa rýchlo rozpúšťajú vo vlhkých prostrediach.
Jeho vzorec naznačuje, že podiel K iónov+ a nie2- Je to 1: 1 a zostávajú zjednotené elektrostatickými silami alebo iónovými väzbami. Čisté prírodné zdroje sa zjavne nenašli pre svoje kryštály, hoci anióny Niter sa nachádzajú v pôdach, hnojivách, rastlinách a zvieratách.
 Kryštály draselného. Zdroj: Leiem [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]
Kryštály draselného. Zdroj: Leiem [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Horný obrázok ukazuje, ako vyzerajú kryštály Kno2, S výraznými žltými tónmi. Ak tieto kryštály zostanú v kontakte so vzduchom, absorbujú vlhkosť, aby sa stali vodným roztokom; riešenie, ktoré vyvolalo kontroverzie, pokiaľ ide o to, či je jeho použitie prospešné alebo nie.
Na druhej strane sa jeho kryštály vo veľmi malých množstvách (200 ppm) používajú na salách mäsa a na zaručenie ich ochrany proti bakteriálnemu pôsobeniu. Tiež Kno2 Vylepšuje farbu mäsa a otáča ich červenkastejšie; Podlieha však niekoľkým obmedzeniam, aby sa predišlo toxickým účinkom tejto soli na telo.
[TOC]
Štruktúra nitritu draselného
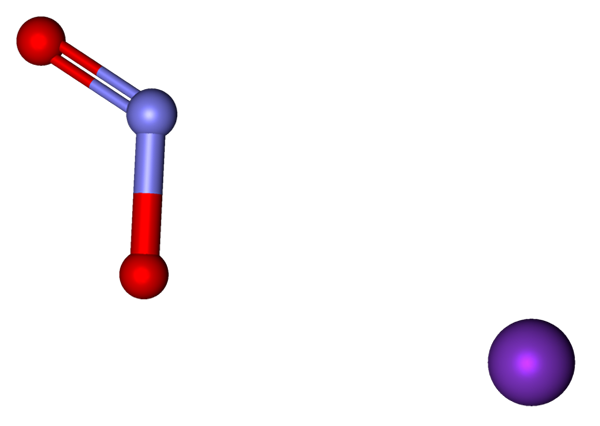 Ióny, ktoré tvoria KNO2 predstavované s modelom sfér a tyčí. Zdroj: Marinavladivok [CC0].
Ióny, ktoré tvoria KNO2 predstavované s modelom sfér a tyčí. Zdroj: Marinavladivok [CC0]. Ióny prítomné v dusíku draselného sú uvedené vyššie. Katión K+ zodpovedá fialovej gule, zatiaľ čo anión nie2- Sú zastúpené modrami a červenými guľami.
Anión nie2- Je znázornená s dvojitou väzbou a jednoduchou väzbou [o = n-o]-; Ale v skutočnosti sú obe spojenia rovnaké ako výsledok rezonancie negatívneho zaťaženia medzi nimi.
K ióny+ a nie2- Priťahujú sa vo vesmíre, aby usporiadali štrukturálny vzor s najmenšou energiou; To je tam, kde sú odpor medzi rovnakým zaťažením minimálne. A tak veria kryštál Kno2, ktorej jednotková bunka je náchylná na zmeny teploty, ktoré fázový prechádza.
Môže vám slúžiť: Stanislao CannizzaroNapríklad pri nízkych teplotách (menej ako 25 ° C) kryštály KNO2 Prijať monoklinický systém (fáza I). Keď teplota presahuje 25 ° C, dochádza k rhomboébickému monoklinickému fázovému prechodu (fáza II). Nakoniec, nad 40 ° C kryštály KNO2 Zmena na kubický (fáza III).
Tiež Kno2 môže vykazovať ďalšie kryštalické fázy (fázy IV, V a VI) pri vysokých tlakoch. S týmto, K ióny+ a nie2- Nakoniec sa pohybujú a objednávajú rôznymi spôsobmi v ich čisto kryštáloch.
Vlastnosti
Molekulárna hmotnosť
85 1038 g/mol.
Hustota
1 9150 g/ml.
Bod topenia
440,02 ° C (ale začína sa rozkladať z 350 ° C, emitujúce toxické výpary).
Bod varu
537 ° C (výbuch).
Rozpustnosť
312 g/ 100 g vody pri 25 ° C.
Delikvencia
Jeho rozpustnosť vo vode je taká, že je hygroskopická; Toľko, že vykazuje delikcenciu a absorbuje dostatočnú vlhkosť na rozpustenie. Táto afinita k vode môže byť spôsobená energetickou stabilitou, ktorú K ióny získavajú+ Pri hydratácii, ako aj entalpia s nízkou kryštalickou sieťou pre kryštály KNO2.
Kryštály môžu absorbovať vodu bez rozpustenia, aby sa stali hydrát2· H2Ani. V hydráte je molekula vody sprevádzaná iónmi, ktoré modifikujú kryštalickú štruktúru.
Tento hydrát (alebo niekoľko z nich) sa môže vytvoriť pod -9 ° C; Pri vyššej teplote sa voda rozpustí a hydratuje ióny, deformuje sklo.
Rozpustnosť v iných rozpúšťadlách
Mierne rozpustný v horúcom alkoholu a veľmi rozpustný v amoniaku.
pH
6-9. Jeho vodné roztoky sú preto zásadité, pretože anión nie je2- Môže hydrolyizovať.
Menovanie
Na klepnutie2 Môže byť tiež pomenovaný inými spôsobmi. „Dusičnan draselný“ zodpovedá názvu tejto soli podľa nomenklatúry zásob; „Nitrito draselný“ podľa systematickej nomenklatúry, v ktorej je zvýraznená jediná valencia draslíka +1; a dioxonitrát (III) draslíka podľa systematickej nomenklatúry.
Môže vám slúžiť: dibenzalacetona: vlastnosti, reakčný mechanizmus, použitie, rizikáDraslík 'dioxonitrát (III), zdôrazňuje valenciu +3 atómu dusíka. Dokonca aj meno, ktoré najviac odporúča IUPAC pre KNO2, „Dusičnan draselný“ je naďalej najpohodlnejší a najjednoduchší pamätať si.
Získanie
Najpriamejším spôsobom, ako ho syntetizovať, ale s nižším výkonom, je prostredníctvom tepelného rozkladu dusičnanu draselného alebo soľného slaného potrubia pri 400 ° C alebo viac:
2kno3 => Kno2 + Ani2
Avšak časť Kno2 Nakoniec sa rozkladajú tepelne, okrem iných výrobkov.
Ďalšou metódou na jeho prípravu alebo syntetizáciu s vyšším výkonom je zníženie KNO3 V prítomnosti olova, medi alebo zinku. Rovnica pre túto reakciu je nasledovná:
Pokaziť sa3 + Pb => kno2 + PBO
Draslík a dusičnan olovo sú zmiešané stechiometricky na železnej panvici, kde sa spájajú s neustálym miešaním a zahrievaním na pol hodiny. Oxid olovo (ii) je žltý a výsledné cesto je horúce a ošetrené vriacou vodou. Potom horúce zmes filtre.
Horúce filtračné bubliny s oxidom uhličitého po dobu piatich minút, čo vyvolá olovo uhličitan, PBCO3, nerozpustný. Týmto spôsobom je olovo dokončený. Kyselina dusičná zriedená na filtrovanie sa pridá, až kým nie je pH neutrálne, nechá sa ochladiť a nakoniec sa voda odparuje tak, aby sa vytvorili kryštály KNO2.
Žiadosti
Aditívna činnosť
Dusičnan draselný sa používa ako prísadka na vyliečenie červeného mäsa, udržiavanie svojej chuti a viac času počas skladovania, zatiaľ čo oneskoruje bakteriálne pôsobenie a určité toxíny, ako napríklad botulinik. Preto vykazuje antibakteriálny účinok.
Kno2 Oxiduje nie, ktorý reaguje s myoglobínom mäsa, a preto nakoniec modifikuje svoju prirodzenú červenú farbu. Potom, keď sa mäso uvarí, získa svoju charakteristickú silnú ružovú farbu.
Môže vám slúžiť: 20 príkladov chemickej sublimácie a charakteristíkAvšak za podmienok bez zadania KNO2 reaguje s mäsovými bielkovinami, aby sa vznikol nitrozamínu, ktorý sa môže stať karcinogénnym.
Na druhej strane, Kno2 (Aj keď najlepšie Nano2) Je to analytické činidlo, ktoré sa môže použiť pri syntéze azoických farbív (reakcia kyseliny dusnej s aromatickými amínmi) a pri analýze aminokyselín.
Antidotum
Aj keď má svoje negatívne účinky, Kno2 Pôsobí ako antidotum u otrávených pacientov s kyanidmi a sulfidom vodíka. Jeho mechanizmom je oxidovať centrá viery2+ k viere3+ zo skupín, ktoré máme o hemoglobíne, produkujúce methemoglobín, ktorý potom reaguje s aniónmi CN- a HS-.
Lekári
V žalúdočnej šťavy žalúdka anión nie je2- Zníži sa na nie, o ktorom je známe, že má vazodilatátorový účinok, zvyšuje prietok krvi. V iných oblastiach tela, kde pH nie je dostatok kyseliny, sú za zníženie ne - nere -2-.
Kno sa použil2 na liečbu chorôb a chorôb, ako je pectory na hrudi a epilepsia (s veľmi negatívnymi vedľajšími účinkami).
Odkazy
- Wikipedia. (2019). Dusitan draselný. Zdroj: In.Wikipedia.orgán
- Prebchem. (2016). Prípravok dusitan draselný. Získané z: Prepchem.com
- Mark Gilchrist, Angela C. Pobrežie, Nigel Benjamin. (2011). Anorganický dusičnan a dusitan a kontrola krvného tlaku, kardiovaskulárny výskum, zväzok 89, vydanie 3, 15. februára 2011, strany 492-498, doi.org/10.1093/CVR/CVQ309
- Publikácia. (2019). Dusitan draselný. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Chemická formulácia. (2018). Dusitan draselný. Získané z: Quimica Formulation.com
- Národné centrum pre rozvoj translačných vied. (2011). Dusitan draselný. Získané z: drog.NCATS.Io
- Richard J. Eley, Paul B. Addis a Joseph J. Vojnový. (1992). Dusitan v mäse. University of Minnesota.
- N. R. Rao, B. Prakash a m. Natarajan. (1975). Transformácie kryštálovej štruktúry v anorganických dusičnanoch, dusičnanoch a uhličitanom. Oddelenie chémie, Indický technologický inštitút, Kanpur, India.
- « Charakteristiky politickej reči, typy, problémy a príklady
- Znečistenie odpadu, dôsledky a príklady »

