Dusičnan meďnatého (II)
- 4875
- 379
- Mgr. Pravoslav Mokroš
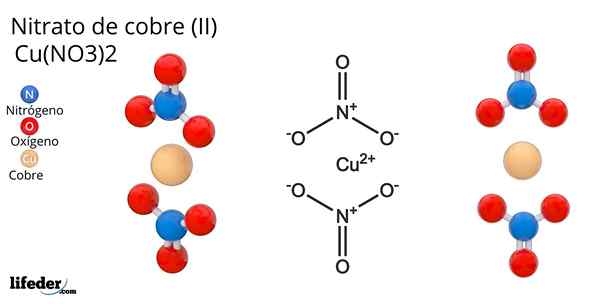
 Vzorec a štruktúra dusičnanu medi (II)
Vzorec a štruktúra dusičnanu medi (II) On dusičnan medený Ii) alebo dusičnanový dusičnan, ktorého chemický vzorec je Cu (nie3)2, Je to vynikajúca anorganická soľ a atraktívne modro-zelené farby. Je syntetizovaný v priemyselnom meradle od rozkladu minerálov medených minerálov vrátane minerálov Gerhardita a Rouaita.
Ďalšie uskutočniteľnejšie metódy, pokiaľ ide o surovinu a požadované množstvo soli, pozostávajú z priamych reakcií s kovovou meďou a jej odvodenými zlúčeninami. Keď je meď v kontakte s koncentrovaným roztokom kyseliny dusičnej (HNO3), dochádza k redoxnej reakcii.
V tejto reakcii oxiduje meď a dusík sa zníži podľa nasledujúcej chemickej rovnice:
Cu (s) + 4Hno3(conc) => cu (nie3)2(Ac) + 2h2Alebo (l) + 2NO2g)
Oxid dusíka (nie2) je hnedý a škodlivý plyn; Výsledný vodný roztok je modrý. Meď môže tvoriť ión Cuprous (Cu+), Cupric ión (cu2+) alebo najmenej spoločné iónové cu3+; Cuprous ión nie je však vo vodných médiách uprednostňovaný mnohými elektronickými, energetickými a geometrickými faktormi.
Štandardný potenciál redukcie Cu+ (0,52 V) je väčšie ako pre Cu2+ (0,34V), čo znamená, že Cu+ Je nestabilnejší a má tendenciu vyhrať elektrón, aby sa stal Cu (S). Toto opatrenie elektrochémie vysvetľuje, prečo neexistuje Cuno3 ako produkt reakcie alebo aspoň vo vode.
[TOC]
Vlastnosti dusičnanov medi
 Vzhľad dusičnanu medi (II) Triohydrát
Vzhľad dusičnanu medi (II) Triohydrát Dusičnan medi je anhydrid (suchý) alebo hydratovaný s rôznymi pomermi vody. Anhydrid je modrá kvapalina, ale po koordinácii s molekulami vody - schopné tvoriť vodíkové mostíky - kryštalizuje to, ako Cu (nie3)2· 3H2O o cu (nie3)2· 6h2Ani. Toto sú tri najdôležitejšie soľné formy na trhu.
Môže vám slúžiť: Helmholtz Free Energy: Jednotky, ako sa vypočítava, vyriešené cvičeniaMolekulová hmotnosť pre suchú soľ je 187,6 g/mol, čo zvyšuje túto hodnotu 18 g/mol pre každú molekulu vody začlenenú do soli. Jeho hustota sa rovná 3,05 g/ml a znižuje sa pri každej zabudovanej molekule vody: 2,32 g/ml pre tri hydratovanú soľ a 2,07 g/ml pre soľ-hydratovanú soľ hydratovanú hexa. Nemá žiadny bod varu, ale sublima.
Tri formy dusičnanu medi sú vysoko rozpustné vo vode, amoniaku, dioxáne a etanole. Jeho body topenia zostupujú, keď sa k vonkajšej koordinačnej sfére medi pridáva ďalšia molekula; Po fúzii nasleduje tepelný rozklad dusičnanu medi, ktorý produkuje škodlivé plyny NO2:
2 cu (nie3)2(s) => 2 cuo (s) + 4 č2g)+ alebo2g)
Vyššie uvedená chemická rovnica je pre anhydridovú soľ; V prípade hydratovaných soli sa vodná pary vyskytne aj na pravej strane rovnice.
Elektronická konfigurácia
Elektronická konfigurácia pre ión Cu2+ Je to [ar] 3d9, prezentácia paramagnetizmu (elektrón v 3D orbitáli9 zmizne).
Pretože meď je prechodný kov štvrtého obdobia periodickej tabuľky a stratil dva zo svojich elektrónov vo Valencii na pôsobenie HNO3, Stále má k dispozícii orbitály 4S a 4P na vytvorenie kovalentných väzieb. Ešte viac, Cu2+ Môžete použiť dva z najvzdialenejších 4D orbitálov na koordináciu až šiestich molekúl.
Anióny nie3- Sú ploché a pre Cu2+ Môžete s nimi koordinovať, musí mať hybridizáciu SP3d2 To vám umožňuje osvojiť oktaedrálnu geometriu; To bráni aniniám nie3- byť „zasiahnutý“ medzi nimi.
Môže vám slúžiť: Kondenzovaný vzorec: Čo je a príklady (metán, etán, glukóza ...)To sa dosahuje Cu2+, umiestniť ich do štvorcovej roviny okolo seba. Výsledná konfigurácia atómu Cu v soli je: [AR] 3D94s24p6.
Chemická štruktúra
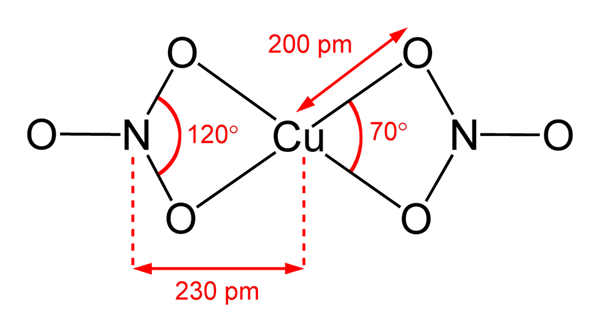 Štruktúra dusičnanov medi (II)
Štruktúra dusičnanov medi (II) Na vynikajúcom obrázku je reprezentovaná izolovaná molekula Cu (nie3)2 v plynovej fáze. Atómy kyslíka dusičnanu sú priamo koordinované s medeným centrom (vnútorná koordinačná guľa) a tvoria štyri väzby Cu-O.
Má molekulárnu geometriu štvorcovej roviny. Rovina je nakreslená červenými guľami vo vrcholoch a medi v strede. Interakcie plynnej fázy sú veľmi slabé kvôli elektrostatickým odporom medzi skupinami nie3-.
V tuhej fáze však medené centrá tvoria kovové spojenia -CU-CU-, čím vytvárajú polymérne medené reťazce.
Molekuly vody môžu tvoriť vodíkové mosty so skupinami nie3-, A tieto budú ponúknuť vodíkové mosty pre ďalšie molekuly vody, atď. Až do gule vody okolo Cu (nie3)2.
V tejto sfére môže mať 1 až 6 vonkajších susedov; Preto sa soľ ľahko hydratuje, aby sa vytvorila hydratované tri a hexa soli.
Soľ sa tvorí z iónov Cu2+ a dva ióny nie3-, Udelenie charakteristickej kryštalinity iónových zlúčenín (ortorrombická pre anhydridovú soľ, rhomboédica pre hydratované soli). Odkazy sú však väčšieho kovalentného charakteru.
Použitie/aplikácie
Pre fascinujúce farby dusičnanu medi sa táto soľ používa ako prísadný v keramike, na kovových povrchoch, v niektorých ohňostrojoch a tiež v textilnom priemysle ako mordant.
Môže vám slúžiť: EnthalpiaJe to dobrý zdroj iónov pre mnoho reakcií, najmä tie, v ktorých katalyzuje organické reakcie. Nachádza tiež podobné použitia ako iné dusičnany, buď ako fungicíd, herbicíd alebo ako drevený konzervačný stav.
Ďalším z jej hlavných a najdôležitejších použití je syntéza katalyzátorov CUO alebo materiály s fotosenzitívnymi vlastnosťami.
Používa sa tiež ako klasické činidlo vo výučbových laboratóriách na vykazovanie reakcií vo voltaických bunkách.
Riziká
- Je to silne oxidačné činidlo, škodlivé pre morské, dráždivé, toxické a korozívne ekosystém. Je dôležité vyhnúť sa všetkým fyzickým kontaktom priamo s činidlom.
- Nie je to horľavé.
- Rozkladá sa pri vysokých teplotách uvoľňujúcich dráždivé plyny medzi nimi2.
- V ľudskom organizme môže spôsobiť chronické poškodenie centrálnych kardiovaskulárnych a nervových systémov.
- Môže spôsobiť podráždenie v gastrointestinálnom trakte.
- Ako dusičnan, v tele sa stáva dusitanom. Dusitan zvyšuje spustošenie hladín kyslíka v krvi a v kardiovaskulárnom systéme.
Odkazy
- Deň, r., & Underwood, a. Kvantitatívna analytická chémia (Piate ED.). Pearson Prentice Hall, P-810.
- Mel veda. (2015-2017). Mel veda. Získané z Mel Science: Melscience.com
- ResearchGate GmbH. (2008-2018). Výskumy. Získané z ResearchGate: ResearchGate.slepo
- Vedecké laboratórium. Vedecké laboratórium. Získané z vedeckého laboratória: ScienceLab.com
- Whitten, Davis, Peck a Stanley. (2008). Chémia (Ôsme vydanie.). P-321. Učenie sa.
- Wikipedia. Wikipedia. Wikipedia sa zotavila: v.Wikipedia.orgán

