Chemická štruktúra dusičnanu bária, použitia, vlastnosti

- 1419
- 326
- Denis Škriniar
On dusičnanník Je to soľ zložená z atómu bária (BA) a dusičnanu (nie3). Prezentuje sa ako biela kryštalická tuhá látka pri teplote miestnosti a existuje v prírode ako veľmi zriedkavý minerál známy ako nitrobarita. Jeho vlastnosti z neho robia toxickú zlúčeninu, ktorú musí byť starostlivo spravovaná.
V skutočnosti má táto zlúčenina viacnásobné využitie vo vojenskom priemysle, pretože môže byť spojená s inými chemickými látkami a pridá sa k výbušným a zápalným formuláciám.
 Vzhľad dusičnanu bárňa. Zdroj: W. Oelen/cc By-SA (https: // creativeCommons.Org/licencie/By-SA/3.0)
Vzhľad dusičnanu bárňa. Zdroj: W. Oelen/cc By-SA (https: // creativeCommons.Org/licencie/By-SA/3.0) [TOC]
Vzorec
Dusičnan bária, tiež nazývaný farbenie bária, má chemický vzorec BA (nie3)2, a zvyčajne sa vyrába dvoma metódami.
Prvý z nich zahŕňa rozpustenie malých kúskov uhličitanu bárnatého (bacchus3) V strednom médiu (HNO3, vysoko korozívna minerálna kyselina), ktorá umožňuje zrážanie nečistôt železa a potom sa táto zmes filtruje, odparí a kryštalizuje.
Druhá metóda sa vykonáva kombináciou chloridu bária (BACL2, Jeden z bárňovacích soli s väčšou rozpustnosť vo vode) s predhriatým roztokom dusičnanu sodného. To vytvára reakciu, ktorá vedie k separácii kryštálov dusičnanov v báze zmesi.
Chemická štruktúra dusičnanu bária
Táto soľ predstavuje charakteristiky kubickej kryštalickej štruktúry alebo bezvodých oktaedros.
Jeho chemická štruktúra je nasledovná:
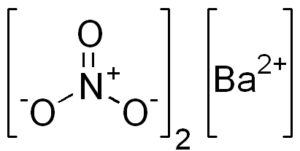
Disociácia
Pri vysokých teplotách (592 ° C) sa dusičnanom bárnat2) a kyslík (alebo2), Podľa nasledujúcej chemickej reakcie:
Môže vám slúžiť: beryl hydroxid (be (oh) 2)2BA (nie3)2 + Teplo → 2BAO + 4NO2 +Ani2
V médiu s vysokými koncentráciami oxidu dusnatého (NO), rozklad dusičnanu bária produkuje zlúčeninu nazývanú bárňa2)2), Podľa nasledujúcej rovnice:
Kúpeľňa3)2 + 2NO → BA (č2)2 + 22
Reakcie s rozpustným síranom kyseliny kovu alebo kyseliny sírovej (h (h2SW4) generujte síran bária (BASO4). Prevažná väčšina nerozpustných solí bária, ako je uhličitan (bacchus3), Oxalát (BAC2Ani4) alebo kovový fosfát (BA3(PO4)2) sú vyzrážané podobnými reakciami s dvojitým rozkladom.
Používa dusičnan bárne
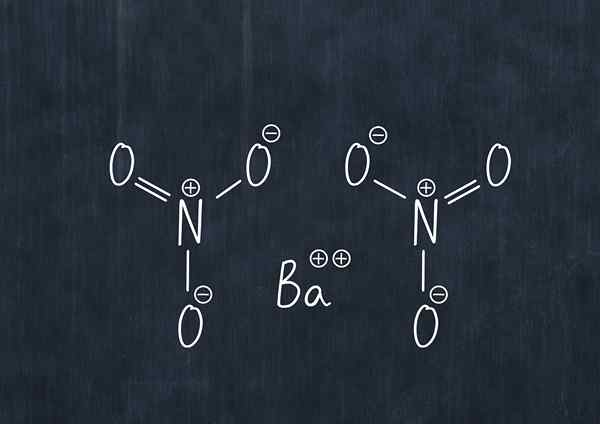 Chemický vzorec dusičnanu bária
Chemický vzorec dusičnanu bária Táto látka v prachu je oxidačným činidlom a významne reaguje s bežnými redukčnými činidlami.
Keď sa táto soľ zmieša s inými kovmi, ako je hliník alebo zinok v jeho jemne rozdelených tvaroch alebo zliatiny, ako je hliník-magn0esio, sa zapne a využíva náraz. Z tohto dôvodu je dusičnan bárne považovaný za vynikajúcu súčasť vojenských zbraní a výbušnín.
Spolu s trinitrotoluénom (komerčne známy ako TNT alebo C6H2(Nie2)3Chvály3) a spojivo (pravidelne parafínový vosk), táto soľ tvorí zlúčenina nazývaná baratol, ktorá má výbušné vlastnosti. Vysoká hustota dusičnanu bárna.
Dusičnan bárňa tiež spája hliníkový prach, vzorec, ktorý vedie k tvorbe blikajúceho guľôčkového prachu, ktorý sa používa hlavne v ohňostrojoch a divadelných pyrotechniciach.
Tieto záblesky tiež videli použitia pri výrobe svetlice (ako sú antimilské miery lietadiel) a v ohromených granátoch. Okrem toho je táto látka veľmi výbušná.
Môže vám slúžiť: Kyanid sodný (NACN): Štruktúra, vlastnosti, riziká, použitiaTáto soľ sa kombinuje so zmesou reaktantu nazývanou termit, aby vytvorila variáciu tohto takzvaného termátu, ktorý na krátku dobu vytvára krátke a veľmi silné záblesky vysokých teplôt v malých oblastiach.
Termát-Th3 je termát, ktorý obsahuje 29 % zloženie pomocou hmotnosti dusičnanu bária, čo pomáha zvyšovať tepelný účinok, vytvára plamene a významne znižuje teplotu zapaľovania termátu.
Terooty sa zvyčajne používajú pri výrobe zápalných granátov a majú funkciu ničenia vojenského panciera a štruktúr.
Okrem toho bol dusičnan bárňa jedným z najpoužívanejších zložiek pri výrobe zápalných poplatkov používaných Briti vo svojich vojnových lietadlách počas druhej svetovej vojny, ktoré vyzbrojili zápalnou muníciou, ktorá slúžila na zničenie nepriateľských lietadiel.
Nakoniec táto soľ má využitie vo výrobnom procese oxidu bárnatého, v priemysle termionických ventilov a, ako už bolo povedané, pri vytváraní pyrotechniky, najmä v zelených farbách.
Fyzikálne a chemické vlastnosti
 Bario Bai Nitrato (NO3) 2
Bario Bai Nitrato (NO3) 2 Soľ je prezentovaná ako biela, hygroskopická a toaletná tuhá látka, ktorá je málo rozpustná vo vode a úplne nerozpustná v alkoholoch.
Má molárnu hmotnosť 261 337 g/mol, hustotu 3,24 g/cm3 a fúzny bod 592 ° C. Po dosiahnutí svojho bodu varu sa rozkladá, ako už bolo uvedené vyššie. Pri teplote miestnosti má rozpustnosť vo vode 10,5 g/100 ml.
Považuje sa za stabilný, ale je to silné oxidačné činidlo a musí byť mimo horľavých materiálov, aby sa predišlo požiaru. Má citlivosť na vodu a nemala by sa zmiešať s kyselinami alebo bezvodými.
Môže vám slúžiť: Adsorpčné izotermy: koncept, typy, príkladyVo vysokých koncentráciách (napríklad kontajnery) musia byť izolované z látok, ktoré ho môžu reagovať, pretože môže násilne využívať.
Rovnako ako každá iná rozpustná zlúčenina bária, je to toxická látka pre zvieratá a ľudské bytosti.
Nemalo by sa vdýchnuť alebo konzumovať, pretože príznaky otravy (najmä kalenie svalov tváre), zvracanie, hnačka, bolesti brucha, tras svalov, úzkosť, slabosť, ťažba respiračných ciest, srdcová nepravidelnosť a záchvaty a záchvaty a záchvaty a záchvaty a záchvaty a záchvaty a záchvaty.
Smrť sa môže vyskytnúť po otrave s touto látkou, niekoľko hodín alebo niekoľko dní po predložení.
Vdýchnutie dusičnanu bária vytvára podráždenie v respiračnej sliznici a v obidvoch spôsoboch otravy musia byť roztoky síranu solí pripravené na uplatnenie prvej pomoci na postihnutú.
V prípade únikov musí byť izolovaný z horľavých látok a materiálov av prípade požiaru by ste nikdy nemali prísť do styku so suchými chemikáliami alebo penami. Ak je oheň väčší, oblasť musí byť zaplavená vodou.
Odkazy
- Mabus. (s.F.). Vedecká doba. Získané z ScienceCemadness.orgán
- Spojené štáty americké bomba TH3-M50A3. (s.F.). Získané z munície.com
- Chemikálie portrétu. (s.F.). Získané z Clasteochemikálií.Noaa.Vláda
- Chempider. (s.F.). Získané od spoločnosti ChemSpider.com

