Metóda redoxnej rovnováhy, kroky, príklady, cvičenia
- 2128
- 306
- Adrián Fajnor
On Metóda vyváženia redoxu Je to taká, ktorá umožňuje vyvážiť chemické rovnice redoxných reakcií, ktoré by inak boli bolesti hlavy. Tu jeden alebo viac druhov vymení elektróny; Ten, ktorý ich daruje alebo stráca, sa nazýva oxidačný druh, zatiaľ čo ten, ktorý ich prijíma alebo vyhrá, redukčný druh.
Pri tejto metóde je nevyhnutné poznať oxidačné čísla týchto druhov, pretože odhaľujú, koľko elektrónov získalo alebo stratilo mol. Vďaka tomu je možné vyvážiť elektrické poplatky zapisovaním v rovniciach elektróny, akoby to boli reaktanty alebo výrobky.
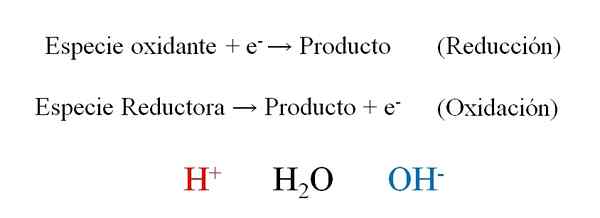
 Všeobecné polo -kolety redoxnej reakcie s tromi protagonistami počas ich vyváženia: H+, H2O a OH-. Zdroj: Gabriel Bolívar.
Všeobecné polo -kolety redoxnej reakcie s tromi protagonistami počas ich vyváženia: H+, H2O a OH-. Zdroj: Gabriel Bolívar. Vynikajúci obrázok ukazuje, ako elektróny efektívne a- Sú umiestnené ako činidlá, keď ich oxidačný druh vyhrá; A ako výrobky, keď ich redukčný druh stratí. Všimnite si, že na vyrovnanie tohto typu rovníc je potrebné zvládnuť koncepty oxidačných a oxidačných čísel.
Druh h+, H2Alebo a oh-, V závislosti od pH reakčného média umožňuje vyváženie redoxu, takže je veľmi bežné ich nájsť v cvičeniach. Ak je médium kyslé, obraciame sa na H+; Ale ak je naopak, médium je základné, potom používame OH- Za vyváženie.
Povaha samotnej reakcie určuje, čo by malo byť pH média. Preto, aj keď je možné vyvážiť predpokladaním kyslého alebo základného média, konečná vyvážená rovnica bude naznačená, či sú ióny H nepravdepodobné alebo nie+ a oh-.
[TOC]
Kroky
- Všeobecný
Skontrolujte oxidačné čísla reagencií a výrobkov
Predpokladajme, že nasledujúca chemická rovnica:
Cu (s) + agno3(Ac) → cu (č3)2 + AG (S)
To zodpovedá redoxnej reakcii, pri ktorej dochádza k zmene oxidačných čísel reagencií:
Cu0(s) + ag+Nie3(Ac) → cu2+(Nie3)2 + AG (S)0
Identifikujte oxidačné a reduktívne druhy
Oxidačný druh získava elektróny oxidujúce redukčné druhy. Preto jeho oxidačné číslo klesá: stáva sa menej pozitívnym. Medzitým sa oxidačný počet redukčných druhov zvyšuje, pretože stráca elektróny: stáva sa pozitívnejším.
V predchádzajúcej reakcii je teda oxidovaná meď, pretože prechádza z Cu0 do Cu2+; A striebro sa znižuje, pretože ide z AG+ Ag0. Meď je redukčný druh a oxidačný druh striebra.
Napíšte semi -reakcie a atómy a zaťaženia vyváženia
Identifikácia toho, ktoré druhy získavajú alebo strácajú elektróny, redoxné semi -reakcie sú napísané pre redukčnú reakciu aj oxidáciu:
Cu0 → Cu2+
Zápis+ → Ag0
Copper stráca dva elektróny, zatiaľ čo strieborné vyhrá jeden. Elektróny umiestnime do oboch semi -reakcií:
Môže vám slúžiť: fosforečnan draselný (K3PO4): Štruktúra, vlastnosti, použitiaCu0 → Cu2+ + 2e-
Zápis+ + a- → Ag0
Všimnite si, že zaťaženia zostávajú vyvážené v obidvoch semi -reakciách; Ale ak by boli pridané, porušil by zákon o ochrane vecí: počet elektrónov musí byť rovnaký. Preto sa druhá rovnica vynásobí 2 a dve rovnice sú pridané:
(Cu0 → Cu2+ + 2e-) x 1
(AG+ + a- → Ag0) x 2
Cu0 + 2Ag+ + 2e- → Cu2+ + 2Ag0 + 2e-
Elektróny sú zrušené za to, že sú na stranách činidiel a výrobkov:
Cu0 + 2Ag+ → Cu2+ + 2Ag0
Toto je globálna iónová rovnica.
Vymeňte koeficienty iónovej rovnice vo všeobecnej rovnici
Nakoniec sa presťahujú na prvú rovnicu na prvú rovnicu: stechiometrické koeficienty predchádzajúcej rovnice:
Cu (s) + 2agno3(Ac) → cu (č3)2 + 2AG (s)
Všimnite si, že 2 boli umiestnené v Agne3 Pretože v tejto soli je striebro ako ag+, A to isté platí pre cu (nie3)2. Ak táto rovnica na konci nie je vyvážená, skóre sa dosiahne.
Rovnica navrhnutá v predchádzajúcich krokoch mohla byť vyvážená priamo Tanteo. Existujú však redoxné reakcie, ktoré potrebujú kyslé médium (h+) alebo základné (OH-) sa uskutočniť. Ak sa to stane, nemôže byť vyvážená za predpokladu, že médium je neutrálne; ako sa práve zobrazilo (nebolo pridané alebo h+ A buď oh-).
Na druhej strane je vhodné vedieť, že semi -reakcie napísali atómy, ióny alebo zlúčeniny (väčšinou oxidy), v ktorých sa vyskytujú zmeny v oxidačných číslach. Toto bude zvýraznené v sekcii cvičení.
- Vyváženie v kyslom médiu
Ak je médium kyslé, musíte sa zastaviť pri dvoch semi -reakciách. Tentoraz v čase rovnováhy ignorujeme atómy kyslíka a vodíka a tiež elektróny. Elektróny budú na konci vyvážené.
Potom, na reakčnej strane s menšími atómami kyslíka, pridávame molekuly vody, aby sme to kompenzovali. Na druhej strane vyrovnávame vodíny s H iónmi+. A nakoniec, pridáme elektróny a pokračujeme v porovnaní s už exponovanými krokmi.
- Vyváženie v základnom médiu
Ak je médium základné, je to rovnaké ako v kyslom prostredí s malým rozdielom: tentoraz na strane, kde je viac kyslíka, sa nachádzajú molekuly vody rovnajúce sa týmto nadbytkom kyslíka; A na druhej strane, Oh ióny- Na kompenzáciu hydrogénov.
Nakoniec, rovnováha elektrónov, pridávajú sa dve semi -reakcie a koeficienty globálnej iónovej rovnice vo všeobecnej rovnici sa nahradia.
Môže vám slúžiť: rozptýlené systémy: typy, charakteristiky a príkladyPríklady
Nasledujúce redoxné rovnice bez rovnováhy a vyvážené slúžia ako príklady na pozorovanie, akú zmenu po použití tejto vyváženej metódy:
P4 + Clo- → PO43- + Cl- (bez rovnováhy)
P4 + 10 CLO- + 6 h2O → 4 PO43- + 10 cl- + 12 h+ (Vyvážená polovica kyseliny)
P4 + 10 CLO- + 12 Oh- → 4 PO43- + 10 cl- + 6 h2O (základné stredne vyvážené)
Jo2 + Pokaziť sa3 → i- + Kio3 + Nie3- (bez rovnováhy)
3i2 + Pokaziť sa3 + 3h2O → 5i- + Kio3 + Nie3- + 6H+ (Vyvážená polovica kyseliny)
Cr2Ani27- + Hned2 → Cr3+ + Nie3- (bez rovnováhy)
3Hno2 + 5H+ + Cr2Ani27- → 3NO3- +2Cr3+ + 4H2O (vyvážená kyselina)
Cvičenia
Cvičenie 1
Vyvážiť nasledujúcu rovnicu v základnom médiu:
Jo2 + Pokaziť sa3 → i- + Kio3 + Nie3-
Všeobecné kroky
Začneme písaním oxidačných čísel druhov, o ktorých máme podozrenie, že majú hrdzavené alebo znížené; V tomto prípade atómy jódu:
Jo20 + Pokaziť sa3 → i- + Ki5+Ani3 + Nie3-
Všimnite si, že jód oxiduje a zároveň sa zníži, takže pokračujeme v písaní jeho dvoch príslušných semi -reakcií:
Jo2 → i- (Redukcia, pre každú i- 1 sa konzumuje elektrón)
Jo2 → io3- (Oxidácia, pre každú IO3- Uvoľňuje sa 5 elektrónov)
V oxidačnom semifviku umiestnime anión io3-, a nie na atóm jódu ako ja5+. Vyvážime atómy jódu:
Jo2 → 2i-
Jo2 → 23-
Vyváženie v základnom médiu
Teraz sa zameriavame na hojdanie v základnom médiu na poloakovanie oxidácie, pretože má okysličenú druhu. Pridávame na stranu produktov rovnaký počet molekúl vody, ako sú atómy kyslíka:
Jo2 → 23- + 6H2Ani
A na ľavej strane vyvážime vodíny s OH-:
Jo2 + 12OH- → 23- + 6H2Ani
Píšeme dve semi -reakcie a pridávame chýbajúce elektróny, aby sme vyvážili záporné zaťaženie:
Jo2 + 2e- → 2i-
Jo2 + 12OH- → 23- + 6H2O + 10e-
Zodpovedali sme obidve čísla elektrónov v obidvoch semi -reakciách a pridávali sme ich:
(Jo2 + 2e- → 2i-) x 10
(Jo2 + 12OH- → 23- + 6H2O + 10e-) x 2
12i2 + 24 Oh- + 20E- → 20i- + 43- + 12H2O + 20e-
Elektróny sú zrušené a rozdelené všetky koeficienty štyrmi, aby sa zjednodušila globálna iónová rovnica:
(12i2 + 24 Oh- → 20i- + 43- + 12H2O) x ¼
3i2 + 6OH- → 5i- + Io3- + 3h2Ani
A nakoniec, nahradíme koeficienty iónovej rovnice v prvej rovnici:
3i2 + 6OH- + Pokaziť sa3 → 5i- + Kio3 + Nie3- + 3h2Ani
Môže vám slúžiť: iónová sila: jednotky, ako ho vypočítať, príkladyRovnica je už vyvážená. Porovnajte tento výsledok s vyvážením v kyslom médiu príkladu 2.
Cvičenie 2
Vyvážiť nasledujúcu rovnicu v kyslom médiu:
Vernosť2Ani3 + CO → Fe + Co2
Všeobecné kroky
Pozorujeme oxidačné počty železa a uhlíka, aby sme vedeli, ktorý z nich má oxidovaný alebo znížený:
Vernosť23+Ani3 + C2+O → Viera0 + C4+Ani2
Železo sa znížilo, takže je to oxidačný druh. Medzitým je uhlík hrdzavý a správa sa ako redukčný druh. Semi -reakcie na oxidáciu a reláciu sú:
Vernosť23+Ani3 → Viera0 (zníženie, pre každú vieru sa spotrebúvajú 3 elektróny)
Co → co2 (Oxidácia, pre každú CO2 Uvoľňujú sa 2 elektróny)
Všimnite si, že píšeme oxid, viera2Ani3, Pretože obsahuje vieru3+, Namiesto toho, aby ste len umiestňovali vieru3+. Vyvážime potrebné atómy, s výnimkou kyslíka:
Vernosť2Ani3 → 2FE
Co → co2
A vyrovnávanie sa vykonáva v kyseline v oboch semi -reakciách, pretože medzi nimi sú okysličené druhy.
Vyváženie v kyslom médiu
Pridávame vodu na vyváženie kyslíka a potom h+ Vyvážiť vodíny:
Vernosť2Ani3 → 2FE + 3H2Ani
6H+ + Vernosť2Ani3 → 2FE + 3H2Ani
Co + h2O → co2
Co + h2O → co2 + 2h+
Teraz vyvážime zaťaženia umiestnením elektrónov zapojených do polopremections:
6H+ + 6e- + Vernosť2Ani3 → 2FE + 3H2Ani
Co + h2O → co2 + 2h+ + 2e-
Zhodujeme sa s počtom elektrónov v obidvoch semi -reakciách a pridávame ich:
(6h+ + 6e- + Vernosť2Ani3 → 2FE + 3H2O) x 2
(CO + H2O → co2 + 2h+ + 2e-) x 6
12 h+ + 12E- + 2FE2Ani3 + 6 CC + 6H2O → 4FE + 6H2O + 6Co2 + 12H+ + 12E-
Zrušujeme elektróny, H ióny+ A molekuly vody:
2FE2Ani3 + 6Co → 4FE +6Co2
Ale tieto koeficienty sa dajú rozdeliť dvoma, aby sa rovnica ešte viac zjednodušila, ak má:
Vernosť2Ani3 + 3Co → 2FE +3CO2
Vyvstáva táto otázka: Redox Balancing pre túto rovnicu bolo potrebné? Tanteo by to bolo oveľa rýchlejšie. To ukazuje, že táto reakcia vychádza zameniteľne zo stredného pH.
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- HelMestine, Anne Marie, PH.D. (22. september 2019). Ako vyvážiť redoxné reakcie. Zotavené z: Thoughtco.com
- Ann Nguyen a Luvleen Brar. (5. júna 2019). Vyváženie redoxných reakcií. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- Quimitube. (2012). Cvičenie 19: Úprava redoxnej reakcie v základnom médiu s dvoma oxidačnými semi -reakciami. Obnovené z: Quimitube.com
- Washingtonská univerzita v St. Louis. (s.F.). Problémy s praxou: Redoxné reakcie. Získané z: chémie.Blednúť.Edu
- John Wiley & Sons. (2020). Ako vyvážiť redoxné rovnice. Získané z: figuríny.com
- Rubén Darío alebo. G. (2015). Vyváženie chemických rovníc. Získané z: Učte sa v Linea.vy.Edu.co

