Metóda algebraického vyváženia (s príkladmi)

- 1138
- 201
- Mgr. Pravoslav Mokroš
On Metóda algebraickej rovnováhy Používa sa v chémii, aby zodpovedala počtu atómov na oboch stranách chemickej reakcie. Chemická reakcia napísaná správne, musí mať vzorce všetkých činidiel zúčastnených na ľavej strane a výrobky, tiež s ich vzorcami, na pravej strane.
Ak však máte reakciu, počet atómov vo vzorcoch reagencií sa rovná atómom atómov vo vzorcoch výrobkov, nie vždy, nie vždy.
 postava 1. Metóda algebraického vyváženia je jednoduchý nástroj na vyváženie chemických rovníc. Zdroj: f. Zapata.
postava 1. Metóda algebraického vyváženia je jednoduchý nástroj na vyváženie chemických rovníc. Zdroj: f. Zapata. Cesto je však zachované. Pozrime sa napríklad na nasledujúcu reakciu:
KCL3 → kcl + o2
Táto rovnica má zlúčeninu nazývanú chlorečnan draselný, ktorá sa rozkladá zahrievaním v chloridu draselného a plynného kyslíka. Ale keď sa pozorne sledujeme, všimneme si, že v chlorovanej molekule sú 3 atómy kyslíka, zatiaľ čo vpravo existuje iba jedna plynná molekula kyslíka s 2 atómami.
To, čo sa potom robí, je vynásobenie numerickým koeficientom na činidlo ľavice, takže počet atómov všetkých zúčastnených prvkov je rovnaký pred a po reakcii.
Ale ... aká je hodnota tohto koeficientu?
[TOC]
Spôsoby, ako vyvážiť rovnice
V predchádzajúcej rovnici je ľahké určiť príslušné koeficienty inšpekciou. Ak vynásobíme 2 na ľavej strane, máme 2 atómy K, 2 Cl a 6 O.
Preto napravo vynásobíme chlorid draselný 2 a O2 do 3:
2 kclo3 → 2KCl + 3o2
A teraz vidíme, že účtovníctvo je správne na oboch stranách šípky a reakcia bola vyvážená. Všimnite si, že ďalšie numerické hodnoty môžu tiež viesť k vyváženej rovnici, napríklad:
Môže vám slúžiť: kyselina boritá: chemická štruktúra, vlastnosti, príprava, použitia4 kclo3 → 4KCl + 6o2
Sada celých minimálnych čísel, ktoré sa rovnajú množstvu atómov na oboch stranách.
Čísla, ktoré vynásobia každý vzorec, sa nazývajú koeficienty. Je veľmi dôležité poznamenať, že koeficienty môžu byť priradené k vyváženiu, ale predplatné musia zostať tak, ako sa objavujú v každom vzorci.
Koeficienty sa nemôžu vložiť do stredu vzorca každej zlúčeniny, pretože by ju zmenili.
Jednoduché rovnice, ako napríklad príklad, môžu byť vyvážené inšpekciou alebo skóre. Pre tých, ktorí sú o niečo zložitejší.
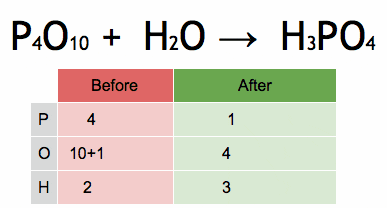 Obrázok 2. Animácia, ktorá ukazuje vyváženie chemickej rovnice na získanie kyseliny fosforečnej. Zdroj: Wikimedia Commons. Ephert/CC By-SA (https: // creativeCommons.Org/licencie/By-SA/4.0)
Obrázok 2. Animácia, ktorá ukazuje vyváženie chemickej rovnice na získanie kyseliny fosforečnej. Zdroj: Wikimedia Commons. Ephert/CC By-SA (https: // creativeCommons.Org/licencie/By-SA/4.0) Kroky na algebraicky vyváženie chemickej rovnice
Krok 1
-Priraďte každej molekule ľubovoľný koeficient, symbolizovaný písmenom. Texty A, B, C, D .. ., Podľa potreby.
Dôležité: Pripomeňme, že molekula používa iba koeficient a nikdy nie je rozptýlený v strede, je vždy umiestnený vľavo doľava.
Krok 2
-Urobte zoznam každého zúčastneného prvku.
Krok 3
-Umiestnite koeficient alebo koeficienty priradené každej zlúčenine doľava a porovnajte ich vpravo. Ak existujú predplatné, vynásobia sa koeficientom na nájdenie celkového počtu atómov.
A ak sa nejaký prvok nachádza vo viac ako jednej molekule, pridajú sa množstvá atómov prítomných na každej strane. Takto čiastočné rovnice každý prvok.
Krok 4
-K jednému z koeficientov je priradená numerická hodnota. Zvyčajne je táto numerická hodnota 1 a je priradená k písmenu, ktoré sa objavuje viackrát. To dosahuje jednoduchú rovnicu, ktorá slúži ako východiskový bod na nájdenie ostatných koeficientov.
Môže vám slúžiť: Faktor zriedeniaKrok 5
-Určite hodnotu nasledujúceho koeficientu jednoduchou aritmetikou a nahradiť jeho hodnotu v inej rovnici, aby ste zvýšili nový.
Krok 6
-Zopakujte predchádzajúci krok na nahradenie hodnôt a vytvorenie novej rovnice, kým nenájdete všetky koeficienty.
Krok 7
-Nahraďte takto stanovené hodnoty. Ak sú tieto hodnoty celé, treba overiť, či bola rovnica vyvážená. Ak neboli celé, vynásobí sa minimálnym bežným násobkom menovateľov a skontroluje sa zostatok.
Potom si predstavíme použitie týchto krokov v rozlíšení niektorých príkladov.
Vyriešené príklady vyváženia
Príklad 1
V prípade potreby rovnováha nasledujúca reakcia prostredníctvom algebraickej metódy:
N2Ani5 → N2Ani4 + Ani2
Riešenie
Poznamenávame, že reakcia nie je vyvážená, pretože hoci sú na oboch stranách 2 atómy dusíka, s kyslíkom, množstvá vľavo a pravá sú rôzne.
Potom musíme postupovať podľa krokov opísaných v predchádzajúcej časti:
-Píšeme rovnicu znova a vynásobíme každú molekulu iným koeficientom. Malé písmená sú vybrané tak, aby sa nezamieňali s prvkami:
Ark2Ani5 → Blekn2Ani4 + Clek2
-Teraz uvádzame každý prvok a priraďujeme množstvá tohto prvku vľavo a doprava. Toto sú čiastočné rovnice pre každý prvok:
- Ark2 = B⋅n2
- Ark5 = B⋅o4 + Clek2
-Vynásobenie koeficientu a indexu Získame počet atómov dusíka. Z rovnice 1 dostaneme:
2A = 2B
-Rovnice 2 má 5 atómy kyslíka vľavo, zatiaľ čo vpravo existujú 4b a 2 c:
5a = 4b + 2c
-Týmto spôsobom priraďujeme hodnotu 1 koeficientu A:
A = 1
Táto voľba je svojvoľná, mohla by sa zvoliť aj ako prvá b = 1.
-Tieto hodnoty sa nahradia v rovnici 2, aby sa určila hodnota C:
Môže vám slúžiť: Cupric Oxid (CUO)5 = 4 + 2c
2C = 5-4 = 1
C = ½
-Nahradíme koeficienty v pôvodnej rovnici, 1 nie je potrebné ich výslovne písať:
N2Ani5 → N2Ani4 + ½ o2
-Pretože je výhodné, aby koeficienty boli celé, celá rovnica sa vynásobí minimálnym bežným násobkom menovateľov, ktoré sú 2 a 1:
m.c.m. (1,2) = 2
Potom sa získajú vynásobením ľavej a doprava o 2, získa sa:
2n2Ani5 → 2n2Ani4 + Ani2
A spočítame počet atómov na oboch stranách, aby sme skontrolovali rovnováhu:
- N vľavo: 4
- Alebo vľavo: 10
- N doprava: 4
- Alebo vpravo: 8 + 2 = 10
Príklad 2
Rovnováha nasledujúca chemická reakcia:
NAHCO3 → NA2Co3 + H2Alebo + co2
Riešenie
Každú molekulu vynásobíme iným koeficientom:
Ark NAHCO3 → Blekna2Co3 + Clek2O + d⋅co2
Potom navrhujeme účtovníctvo každého prvku doprava a naľavo od šípky. V reakcii je celkom 4 prvky: sodík Na; Vodík H; auto a kyslík alebo, všetko sa musí spočítať:
- A⋅na = b⋅na2
- ark = clekh2
- A⋅c = b⋅c + d⋅c
- Ark3 = B⋅o3+C⋅o+d⋅o2
Podľa každého zostatku sa získajú nasledujúce rovnice:
1) a = 2b
2) a = 2c
3) A = B + D
4) a = 3b + c + 2d
Najopakovanejší koeficient je do, Preto priraďujeme hodnotu 1:
A = 1
Tak:
1) a = 2b ⇒ b = ½
2) a = 2c ⇒ c = ½
3) a = b + d ⇒ d = a - b = 1 - ½ = ½
Nahradíme koeficienty v rovnici:
NAHCO3 → ½. Nat2Co3 + ½. H2O + ½.Co2
Mestíme na oboch stranách šípky 2, pretože je prítomným jediným menovateľom, ktorý eliminuje frakciu:
2Nahco3 → NA2Co3 + H2Alebo + co2
Počítame počet atómov prítomných vľavo: 2 atómy Na, H a C a 6 O. Čitateľ môže overiť, či je každý z nich prítomný aj vpravo v rovnakých množstvách.
Odkazy
- Atkins, str. Princípy chémie: Cesty objavovania. PAN -AMERICKÝ ZDROJE. 3. vydanie.
- Briceño, J. Sprievodca chémiou USB. Získané z: gecousb.com.ísť.
- Chang, R. 2013. Chémia. 11 VA. Vydanie. MC Graw Hill Education.
- Vyriešené cvičenia. Algebraické vyváženie. Zdroj: Suelted Cvičenia.co.
- Simoza, L. Vyváženie chemických rovníc. Získané z: Guao.orgán.
- « Charakteristiky mŕtvych poplatkov, výpočet, príklady
- Funkcie architektúry Inkov a vynikajúce konštrukcie »

