Molitalita

- 1524
- 7
- MUDr. Miloslav Habšuda
Čo je molealita?
Ten Molitalita, označený písmenom M v malom písme je to termín používaný na opis koncentrácie roztoku. Môže byť definovaný ako počet mólov rozpustenej látky rozpustenej v 1 kilograme rozpúšťadla.
Rovná sa s mólmi rozpustenej látky (látka, ktorá sa rozpúšťa) delená kilogramami rozpúšťadla (látka použitá na rozpustenie).

Kde sú móly rozpustených látok dané rovnicou:
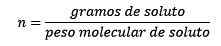
Nakoniec teda zostáva mólska rovnica
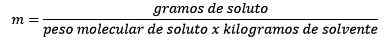
Charakteristiky moleality
- Mollalita je miera koncentrácie rozpustenej látky v roztoku. Sa používa hlavne, keď je teplota problémom.
- Molitalita nie je taká bežná ako jej náprotivok, molarita (móly rozpustenej látky pre každý liter rozpúšťadla), ale používa sa vo veľmi špecifických výpočtoch, najmä s ohľadom na koligatívne vlastnosti (zvýšenie bodu varu, depresia bodu zmrazenia). Pretože objem je vystavený variácii v dôsledku teploty a tlaku, molarita sa tiež mení podľa teploty a tlaku.
- V niektorých prípadoch je využívanie hmotnosti výhodou, pretože hmotnosť sa nemení v závislosti od podmienok prostredia.
- Je dôležité, aby sa použila hmota rozpúšťadla a nie hmotnosť roztoku.
- Roztoky označené morálnou koncentráciou sú označené malými písmenami M. Roztok 1,0 m obsahuje 1 mol rozpustenej látky na kilogram rozpúšťadla.
- Príprava daného riešenia morálky je ľahká, pretože vyžaduje iba dobrý rozsah. Rozpúšťadlo aj rozpustená látka sú zmiešané, namiesto toho, aby sa merali podľa objemu.
Môže vám slúžiť: kyselina propán- Jednotka SI (medzinárodný systém) pre molity je mol/kg alebo móla rozpustená na kg rozpúšťadla. Roztok s moleity 1 mol/kg sa často opisuje ako „1 mol“ alebo „1 ma“.
Podľa systému jednotiek SI však Národný inštitút štandardov a technológií, ktorý je autoritou Spojených štátov na meranie, sa domnieva, že pojem „morálny“ a symbol „M“ je zastaraný a navrhuje použitie mol/kg.
Rozdiely a podobnosti medzi molealitou (M) a molaritou (M)
Príprava roztoku danej morálky znamená váženie rozpustenej a rozpúšťadla a získanie jeho hmotností.
Ale v prípade molarity sa meria objem roztoku, ktorý ponecháva priestor pre zmeny hustoty v dôsledku stavu environmentálneho a tlakového stavu.
To znamená, že je to výhodný tlak, zatiaľ čo cesto zostáva nezmenené.
Okrem toho sa chemické reakcie uskutočňujú v hmotnostnom proporcii a nie v objeme. Na spoliehanie sa na cesto sa môže molealita ľahko stať hmotnostným pomerom alebo hmotnostnou frakciou.
Pre vodné roztoky (roztoky, v ktorých je voda rozpúšťadlo) blízko teploty okolia, je rozdiel medzi morálnymi a molárnymi roztokmi opovrhnutý.
Je to preto, že okolo okolitej teploty má voda hustotu 1 kg / l. To znamená, že „pomocou L“ molarity sa rovná „kg“ moleality.
Môže vám slúžiť: kazeinát vápnika: štruktúra, vlastnosti, získanie a použitiePre rozpúšťadlo, ako je etanol, kde je hustota 0,789 kg / l, by 1 m roztok bol 0,789 m.
Dôležitou súčasťou zapamätania tohto rozdielu je:
Molarita - M → Moté na liter roztoku.
MOLLITA - M → Moly na kilogram rozpúšťadla.
Príklady moleality
Príklad 1
Problém: Aká je morálka riešenia obsahujúceho 0.086 mólov NaCl rozpustených v 25,0 g vody?
Odpoveď: V tomto príklade sa používa priama morálna rovnica:
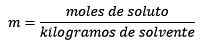
Móly rozpustenej látky (NaCl) = 0,086 mol
Hmotnosť (voda) = 25,0 g = 25,0 x 10-3 kg
Výmena, ktorú máte:
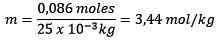
Príklad 2
Problém: Aká je morálka roztoku, ak 124,2 gramov NaOH sa rozpustí v 1,00 litrov vody? (Hustota vody sa rovná 1,00 g/ml).
Odpoveď: Voda je známa ako univerzálne rozpúšťadlo a hustota sa zvyčajne podáva asi 1,00 gramov na mililiter, alebo čo je rovnaké, 1 kilogram na liter. To uľahčuje konverziu z litrov na kilogramy.
V tomto probléme sa bude musieť 124,2 gramov NaOH premieňať na móly (pre móly rozpustenej látky) a liter vody sa bude musieť zmeniť na kilogramy (pomocou kilogramov rozpúšťadla) pomocou hustoty.
Po prvé, existuje molárna hmota Naoh:
POPOLUDNIENat= 22,99 g/mol
POPOLUDNIEAni= 16 g/mol
POPOLUDNIEH= 1g/mol
POPOLUDNIENaoh= 22,99 g/mol +16 g/mol +1 g/mol = 39,99 g/mol
Po druhé, Naohove gramy premieňajú na móly pomocou molárneho cesta:
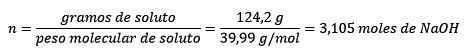
Po tretie, liter vody sa stáva kilogramami pomocou hustoty:
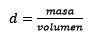
Vyčistenie cesta zostáva:
Môže vám slúžiť: oxid zlata (III) (AU2O3): Čo je, štruktúra, vlastnosti, použitia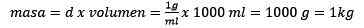
Nakoniec je molelizová rovnica vyriešená:
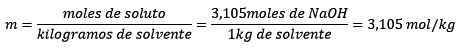
Príklad 3
Problém: Aká je vodná hmotnosť vodného roztoku, ktorý obsahuje 0,52 gramov chloridu bária (bacl2, PM = 208,23 g/mol), ktorého koncentrácia je 0,005 mol/kg?
Odpoveď: V tomto prípade sa morálna koncentrácia používa na určenie množstva vody v roztoku.
Po prvé, získa sa počet mólov BACL2 V riešení:
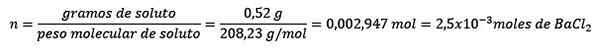
Po druhé, kilogramy rozpúšťadla sú vyčistené z molelizovej rovnice a vyriešené.
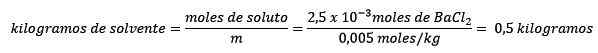
Odkazy
- Výpočet príkladu molality. Zotavené z Sciententes.orgán.
- Čo je príkladom molality? Zotavený zo Sokraticu.orgán.
- (S.F.). Morálka. Zotavené z nekonečného.com.

