Kvantový mechanický model atómu

- 3741
- 1045
- MUDr. Miloslav Habšuda
Aký je kvantový mechanický model atómu?
On Kvantový mechanický model atómu Predpokladá sa, že je tvorené centrálnym jadrom tvoreným protónmi a neutrónmi. Elektróny negatívneho zaťaženia zabaľujú jadro do difúznych oblastí známych ako orbitáli.
Tvar a rozšírenie elektronických orbitálov sú určené niekoľkými veľkostí: základný potenciál a kvantifikované hladiny energie a uhlová hybnosť elektrónov.
 postava 1. Model atómu hélia podľa kvantovej mechaniky. Skladá sa z pravdepodobnostného oblaku dvoch héliových elektrónov, ktoré obklopujú pozitívne jadro 100 000 -krát menšie. Zdroj: Wikimedia Commons.
postava 1. Model atómu hélia podľa kvantovej mechaniky. Skladá sa z pravdepodobnostného oblaku dvoch héliových elektrónov, ktoré obklopujú pozitívne jadro 100 000 -krát menšie. Zdroj: Wikimedia Commons. Podľa kvantovej mechaniky majú elektróny správanie sa s dvojitým vlnovým častikám a atómová stupnica je rozptýlená a nešpecifická. Rozmery atómu sú prakticky určené rozšírením elektronických orbitálov obklopujúcich pozitívne jadro.
Obrázok 1 zobrazuje štruktúru atómu hélia, ktorý má jadro s dvoma protónmi a dvoma neutrónmi. Toto jadro je obklopené oblakom pravdepodobnosti dvoch elektrónov, ktoré obklopujú jadro, ktoré je stotisíc krát menšie. Na nasledujúcom obrázku môžete vidieť atóm hélia, s protónmi a neutrónmi v jadre a elektrónmi na orbitáloch.

Veľkosť atómu hélia je rádovo a angstrom (1 Á), to je 1 x 10^-10 m. Zatiaľ čo veľkosť jeho jadra je rádovo a femtometra (1 fm), to je 1 x 10^-15 m.
Napriek tomu, že je tak malý, 99,9% atómovej hmotnosti sa koncentruje v malom jadre. Je to preto, že protóny a neutróny sú 2 000 -krát väčšie ako elektróny, ktoré ich obklopujú.
Môže vám slúžiť: 31 typov sily vo fyzike a ich charakteristikyAtómová stupnica a kvantové správanie
Jedným z konceptov, ktoré mali najväčší vplyv na vývoj atómového modelu, bola koncepcia duality Vlna - častice: Objav, že každý materiál má vlnu hmoty spojenú.
Vzorec, ktorý umožňuje vypočítať vlnovú dĺžku λ Louis de Broglie navrhol v roku 1924 spojený s materiálnym predmetom a je nasledujúci:
λ = h / (m v)
Kde h Je to Planckova konštanta, m Cesto a vložka rýchlosť.
Podľa princípu De Broglieho má každý objekt dvojité správanie, ale v závislosti od rozsahu interakcií, rýchlosti a hmotnosti môže byť správanie vlny preeminentnejšie ako častice alebo naopak, naopak alebo naopak.
Elektrón je ľahký, jeho hmotnosť je 9,1 × 10^-31 kg. Typická rýchlosť elektrónu je 6000 km/s (päťdesiatkrát menej ako rýchlosť svetla). Táto rýchlosť zodpovedá energetickým hodnotám v rozsahu desiatok elektrónového voltio.
S predchádzajúcimi údajmi a pomocou vzorca de Broglie je možné získať vlnovú dĺžku pre elektrón:
λ = 6,6 x 10^-34 j s / (9,1 × 10^-31 kg 6 x 10^6 m / s) = 1 x 10^-10 m = 1 Á
Elektrón k typickým energiám atómových hladín má vlnovú dĺžku rovnakého rádia ako v atómovej stupnici, takže v tomto rozsahu má ondulačné a nie správanie časticami.
Prvé kvantové modely
S ohľadom na myšlienku, že elektrón atómového stupnice má zvlnené správanie, boli vyvinuté prvé atómové modely založené na kvantových princípoch. Medzi nimi vyniká Bohrov atómový model, ktorý dokonale predpovedal spektrum emisií vodíka, ale nie spektrum iných atómov.
Môže vám slúžiť: Snaha o napätie: vzorec a rovnice, výpočet, cvičeniaBohrov model a následne model Sommerfeld, poloklasické modely. To znamená, že elektrón bol ako častice vystavená elektrostatickej príťažlivej sile jadra, ktorá obežná dráha okolo neho riadi Newtonov druhý zákon.
Okrem toho pre klasické obežné dráhy tieto prvé modely zohľadnili, že elektrón mal pridruženú materiálovú vlnu. Povolené boli iba obežné dráhy, ktorých obvod bol celé číslo vlnových dĺžok, pretože tie, ktoré nespĺňajú toto kritérium, vyblednú deštruktívnym zasahovaním.
Potom sa prvýkrát objaví kvantizácia energie v atómovej štruktúre.
Slovo kvantový Presne vychádza zo skutočnosti, že elektrón môže v atóme brať iba niektoré diskrétne energetické hodnoty. To sa zhoduje s Planckovým nálezom, ktorý pozostával z objavu, že frekvenčné žiarenie F Interagovať s hmotou v energetických balíkoch E = h f, kde h Je to Planckova konštanta.
Orbitálny tvar a veľkosť
Radiálny rozsah orbitálu je určený funkcia rádiudo. Je väčší do tej miery, že energia elektrónu rastie, to znamená do tej miery, že sa hlavné kvantové číslo zvyšuje.
Radiálna vzdialenosť sa zvyčajne meria v Bohr rádiá, ktoré sú pre najnižšiu energiu vodíka 5,3 x 10-11 m = 0,53 Á.
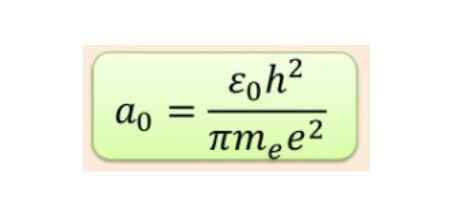 Obrázok 2. Bohr polomer. Zdroj: f. Zapata.
Obrázok 2. Bohr polomer. Zdroj: f. Zapata. Ale forma orbitálov je určená hodnotou kvantového počtu uhlovej hybnosti. Ak l = 0 máte sférický orbitál nazývaný s, ak l = 1 máte lobie orbitál nazývaný p, ktoré môžu mať tri orientácie podľa magnetického kvantového čísla. Nasledujúci obrázok zobrazuje formu orbitálov.
Môže vám slúžiť: Vektorová veľkosť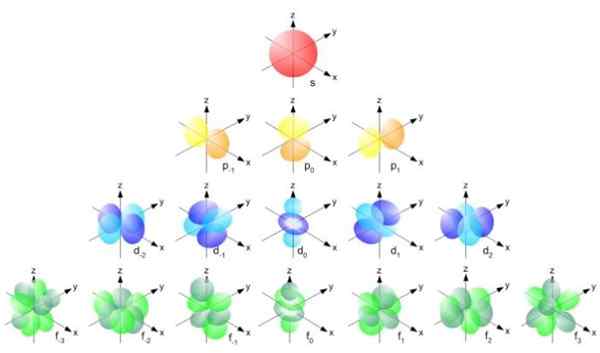 Obrázok 3. Forma orbitálov s, p, d, f. Zdroj: ucdavis chemwiki.
Obrázok 3. Forma orbitálov s, p, d, f. Zdroj: ucdavis chemwiki. Tieto orbitály sú zabalené do ostatných podľa energie elektrónov. Napríklad nasledujúci obrázok zobrazuje orbitály v atóme sodíka.
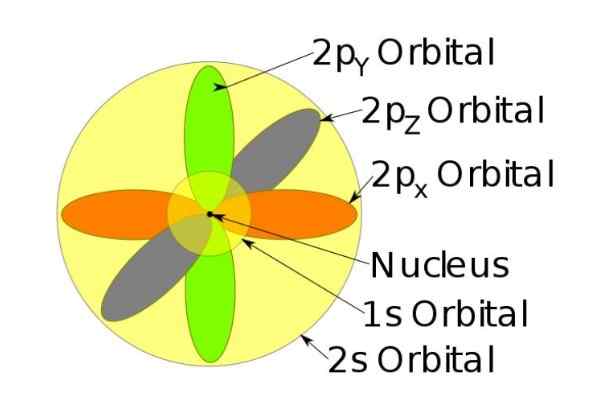 Obrázok 4. Orbitals 1s, 2s, 2p ión sodného, keď stratil elektrón. Zdroj: Wikimedia Commons.
Obrázok 4. Orbitals 1s, 2s, 2p ión sodného, keď stratil elektrón. Zdroj: Wikimedia Commons. Točenie
Kvantový mechanický model Schrödingerovej rovnice nezačína elektrónové rotácie. Ale Pauli sa berie do úvahy prostredníctvom princípu vylúčenia, čo naznačuje, že orbitály môžu napĺňať až dva elektróny s kvantovými spinovými číslami s = +½ a s = -½.
Napríklad, sodný ión má 10 elektrónov, to znamená, že ak odkazujeme na predchádzajúci obrázok, existujú dva elektróny pre každú orbitálnu.
Ale ak je to neutrálny atóm sodíka, existuje 11 elektrónov, z ktorých posledný by zaberal orbitál 3S (nie je znázornené na obrázku a väčšieho polomeru ako 2s). Spin atóm je rozhodujúce v magnetických charakteristikách látky.
Odkazy
- Alonso - Finn. Kvantové a štatistické základy. Addison Wesley.
- Eisberg - Resnick. Kvantová fyzika. Limusa - Wiley.
- Gasiorowicz. Kvantová fyzika. John Wiley & Sons.
- HSC. Kurz fyziky 2. Jacaranda Plus.
- Wikipedia. Atómový model Schrodinger. Získané z: Wikipedia.com

