Korpuskulárny model hmoty
- 3826
- 1075
- MUDr. Miloslav Habšuda
 Najznámejšie stavy tejto záležitosti majú svoje vysvetlenie v korpuskulárnom modeli veci
Najznámejšie stavy tejto záležitosti majú svoje vysvetlenie v korpuskulárnom modeli veci Aký je korpuskulárny model hmoty?
On Korpuskulárny model hmoty Je to model mikroskopickej štruktúry hmoty, ktorá sa snaží vysvetliť vlastnosti a správanie v každom stave agregácie.
Základným postulátom modelu je, že hmota sa skladá z malých častíc, ktorým môžu byť atómy, ióny alebo molekuly, vždy v nepretržitej miešaní.
V tomto modeli sa uplatňujú zákony klasickej mechaniky na častice, hoci podľa veľkého počtu prítomných nie sú študované jednotlivo, ale prostredníctvom štatistickej liečby. Týmto spôsobom sa získajú priemerné hodnoty makroskopických veľkostí, ako je tlak, teplota a objem.
Korpuskulárny model tiež vysvetľuje vlastnosti, ako je viskozita, tvrdosť, flexibilita a hustota materiálov, ako aj tepelná dilatácia, okrem iných javov.
Pôvod korpuskulárneho modelu hmoty
Myšlienky o korpuskulárnej povahe hmoty dátum najmenej 5. storočia.C. V starovekom Grécku, Leucipo (450 a. C. - 370 a. C.) a Demokritus (460 až 370 až c), učeník, špekuloval o organizácii hmoty na mikroskopickej úrovni.
Títo filozofi navrhli, že hmota sa skladá z malých nedeliteľných častíc, vymenovaných atómy, Slovo gréckeho koreňa, ktoré znamená presne „nedeliteľné“.
Túto teóriu vylúčil Aristoteles, najvplyvnejší mudrc jeho doby. Až do sedemnásteho storočia sa však Corpuscular Theory začala znova brať do úvahy relevantnosť av 19. storočí sa nakoniec začali odhaliť tajomstvá hmoty konečne.
V roku 1803 anglický chemik John Dalton (1766-1844) opäť navrhol, že záležitosť bola vytvorená mŕtvymi nazývanými atómami, ktoré sa kombinovali v určitých rozmeroch na vytvorenie molekúl látky.
Daltonove atómy boli nedeliteľné, ale čoskoro sa vyvinula solídna teoretická štruktúra, najmä vďaka Jamesovi C. Maxwell (1831-1979) a Ludwig Boltzmann (1844-1906). Tým sa vytvorili základy štatistickej mechaniky a fyziky tuhého stavu.
Môže vám slúžiť: Priemerná rýchlosť: vzorce, ako sa vypočítava a vyriešiZáklady korpuskulárneho modelu hmoty
Hlavné postuláty modelu sú:
- Hmota, bez ohľadu na ich stav agregácie, je tvorená mikroskopickými časticami, ktoré môžu byť individuálne alebo kombinované atómy, za vzniku molekúl.
- Rôzne látky sa navzájom líšia, pretože sú tvorené rôznymi časticami.
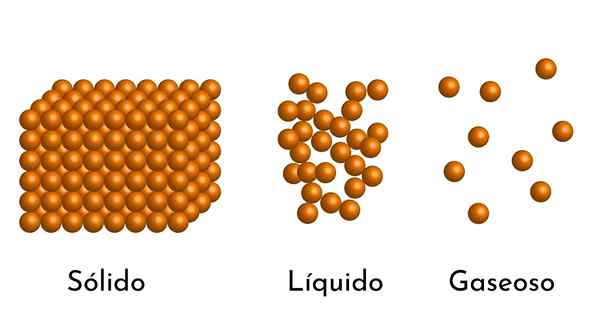
- Podľa stavu agregácie hmoty existujú medzi časticami prázdne priestory, väčšie v plynoch a menšie v tuhých látkach.
- Častice, ktoré tvoria záležitosť, sú v neustálom agitácii. Na väčšie miešanie, väčšia kinetická energia, ktorú majú, a ak sa pridá teplo, zvýši sa pohyb častíc.
- Tiež v kvapalinách a tuhých látkach prežívajú častice príťažlivosť intenzity v dôsledku intermolekulárnych síl. V plynoch sú molekuly veľmi oddelené a rýchlo sa pohybujú, takže tieto sily nemajú väčší výskyt. Ale v kvapalinách, ktorých častice majú väčšiu súdržnosť, sú tieto sily intenzívnejšie a v tuhých látkach sú ešte väčšie.
Kinetická teória plynov
Korpuskulárny model sa aplikoval najskôr na plyny, pretože je najjednoduchším stavom agregácie a súdržných síl medzi molekulami je minimálny. Okrem toho boli vlastnosti plynov dobre známe prostredníctvom experimentálnych diel anglického chemika Roberta Boyla a francúzskeho Josepha Gaya Lussaca a Jacquesa Charlesa.
Model ideálnych plynov, najjednoduchší, uvažuje o tom:
- Veľkosť častíc je oveľa menšia ako vzdialenosti medzi nimi a že rozmery nádoby. Sú to špecifické masy, to znamená, že chýbajú rozmery a nezaberajú objem.
- Častice sú v trvalej miešaní a sú ich pohybom iba prekladu.
- Občas sa častice elasticky zrážajú, navzájom a so stenami nádoby. V úplne elastických šokoch sa zachováva kinetická energia.
- Medzi molekulami nie sú žiadne atraktívne sily. Jediné interakcie sú spôsobené zrážkami, ktoré sa vyskytujú čas od času a na veľmi krátku dobu. Zvyšok každá molekula pôsobí bez ohľadu na ostatné.
- Ak na systém častíc neexistujú žiadne vonkajšie sily.
Aj keď je to najjednoduchší model, vysvetľuje správanie akéhokoľvek hustého plynu pri vysokých teplotách a nízkych tlakoch. Vedci vyvinuli ďalšie lepšie upravené modely správaniu skutočných plynov, pretože to považujú za:
- Molekuly majú merateľnú veľkosť.
- Intermolekulárne sily nie sú zrušené.
Ideálna plynová rovnica
Vďaka postulátom ideálneho plynu vzniká výraz, ktorý sa týka makroskopických veľkostí tlaku P, objemu V a teploty T:
P ∙ v = nrt
Kde n je počet mólov plynu a R je univerzálna konštanta plynov, ktorej hodnota v medzinárodných systémových jednotkách je 8.314 j/mol ∙ k.
Kinetická energia a teplota
V ideálnom plyne sa všetka vnútorná energia prejavuje ako kinetická energia. Priemerná kinetická energia n molekúl ideálneho plynu je priamo úmerná jeho teplote v Kelvin:
Korpuskulárny model v kvapalinách a tuhých látkach
V skutočnosti sa všetky hmoty nachádzajú v troch najjednoduchších štátoch: napríklad plyn, kvapalina alebo tuhá látka, v závislosti od tlaku a teploty. Existujú aj ďalšie agregačné stavy, ako je plazma, ale nie blízko povrchu Zeme.
Tieto stavy sú spôsobené spôsobom, akým pôsobia medzimolekulárne príťažlivé sily, ktoré sú krátke, to znamená, že nekonajú, ak je vzdialenosť medzi molekulami veľmi veľká a častice sa pohybujú pri vysokej rýchlosti. Toto je prípad plynov, ktorý umožňuje jav rozptýlenie rýchlejšie. To vysvetľuje, že odhalením arómy sa aróma rýchlo šíri.
Môže vám slúžiť: Aký je magnetický moment?Na druhej strane, keď sú častice bližšie a ich pohyb je pomalší, rovnako ako v tekutinách a tuhých látkach, tieto intermolekulárne sily majú možnosť vyvíjať svoju činnosť.
Keď teda plyn prechádza do tekutého stavu, jeho objem klesá, pretože vzdialenosť medzi jeho časticami klesá a ešte viac, keď sa stane solídnou.
Hmota v kvapalnom stave
V kvapalnom stave nie sú intermolekulárne sily opovrhnutiahodné, ale pôsobia v menšom meradle ako v pevnom stave. Častice tvoria malé skupiny, ktoré sa neustále rozpadajú a preskupujú, a poskytujú mobilitu materiálu, hoci udržiavajú pevný objem.
Táto mobilita umožňuje tekutiny prispôsobiť sa tvaru nádob. Môže dôjsť k difúzii, ale pomalšie ako v plynoch.
Napriek tomu majú častice dostatočnú súdržnosť, aby kvapalina zostala nestlačiteľná v širokom teplotnom rozsahu.
Povrchové napätie
Na povrchu tekutiny existujú molekuly, na ktorých pôsobia nevyvážené medzimolekulárne sily, čo vedie k čistej sile. Táto čistá sila je minimalizovaná, keď má kvapalina najnižší možný povrch.
Vďaka tejto sile sa špendlíky, sponky, hmyz a ďalšie malé predmety dokážu zostať na pokojnom povrchu vody bez potopenia.
 Na tomto obrázku je na povrchu kvapaliny viditeľná molekula, na ktorej pôsobí čistá sila, čo umožňuje hmyzu chodiť po vode bez potopenia
Na tomto obrázku je na povrchu kvapaliny viditeľná molekula, na ktorej pôsobí čistá sila, čo umožňuje hmyzu chodiť po vode bez potopenia Pevná hmota
V tuhom stave sú častice veľmi blízko seba a medzimolekulárne sily robia častice zostávajú v pevných polohách. Aj keď môžu vibrovať okolo tejto polohy, pevné látky si osvojujú definovanú formu a udržiavajú svoj konštantný objem.
Keď tepla tečie, zvyšuje sa amplitúda vibračného pohybu a zvyšuje sa teplota. To spôsobuje, že sa rozmery tela zvyšujú s teplotou, jav nazývaný Tepelná dilatácia. Ak dostatok tepelných tokov, tuhá látka môže dokonca ísť do kvapalnej fázy.


