Schrödinger atómový model

- 4667
- 838
- Alfréd Blaho
Aký je Schrödingerov atómový model?
On Schrödinger atómový model Je to návrh na prevádzku a štruktúru atómu vyvinuté Erwin Schrödinger v roku 1926. Je známy ako kvantový mechanický model atómu a opisuje vlnové správanie elektrónu.
Z tohto dôvodu bol vynikajúci rakúsky fyzik založený na hypotéze Broglie, ktorá uviedla, že každá pohyblivá častica je spojená s vlnou a môže sa ako taká správať.
 Erwin Schrödinger
Erwin Schrödinger Schrödinger navrhol, že pohyb elektrónov v atóme zodpovedal dualite vĺn, a preto sa elektróny mohli mobilizovať okolo jadra ako stacionárne vlny.
Schrödinger, ktorý získal Nobelovu cenu v roku 1933 za jeho príspevky k atómovej teórii, vyvinul homonymnú rovnicu na výpočet pravdepodobnosti, že elektrón bude v konkrétnej pozícii.
Charakteristiky atómového modelu Schrödinger
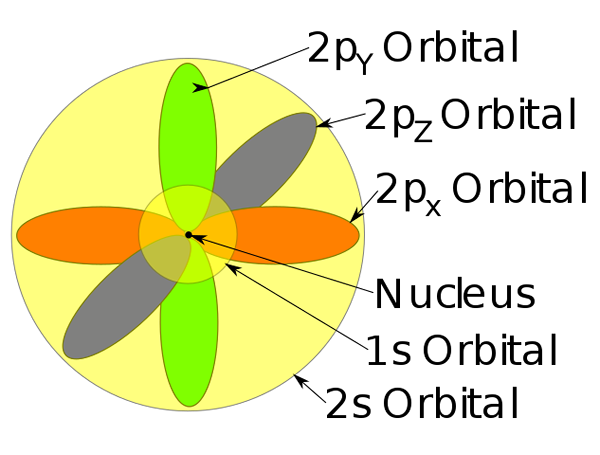 Orbitals 1s, 2s a 2p vo vnútri atómu sodíka.
Orbitals 1s, 2s a 2p vo vnútri atómu sodíka. -Tento model atómu popisuje pohyb elektrónov ako stacionárne vlny.
-Elektróny sa pohybujú neustále, to znamená, že v atóme nemajú pevnú alebo definovanú polohu.
-Tento model nepredpovedá umiestnenie elektrónov, ani neopíše cestu, ktorú vytvára v rámci atómu. Stanovuje iba pravdepodobnostnú zónu na lokalizáciu elektrónu.
-Tieto oblasti pravdepodobnosti sa nazývajú atómové orbitály. Orbitály opisujú prekladový pohyb okolo jadra atómu.
-Tieto atómové orbitály majú rôzne úrovne a energetické podskupiny a dajú sa definovať medzi oblakmi elektrónov.
-Model neuvažuje o stabilite jadra, odkazuje iba na vysvetlenie kvantovej mechaniky spojenej s pohybom elektrónov v atóme.
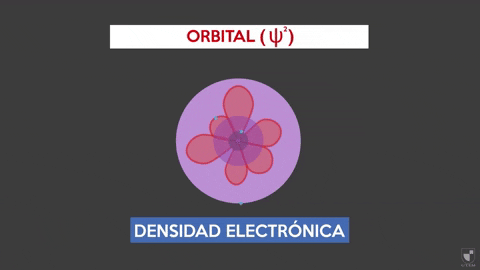 Elektronická hustota naznačuje pravdepodobnosť nájdenia elektrónu v blízkosti jadra. Čím bližšie je jadro (fialová zóna), bude väčšia pravdepodobnosť, zatiaľ čo bude menej, ak sa vzdialite od jadra (fialová oblasť).
Elektronická hustota naznačuje pravdepodobnosť nájdenia elektrónu v blízkosti jadra. Čím bližšie je jadro (fialová zóna), bude väčšia pravdepodobnosť, zatiaľ čo bude menej, ak sa vzdialite od jadra (fialová oblasť). Experimentovať
Schrödingerov atómový model je založený na hypotéze Broglie, ako aj z predchádzajúcich atómových modelov Bohr a Sommerfeld.
Môže vám slúžiť: Dynamické alebo kinetické trenie: koeficient, príklady, cvičeniaBroglie navrhol, že rovnako ako vlny majú častice, častice majú vlnové vlastnosti a majú pridruženú vlnovú dĺžku. Niečo, čo v tom čase vyvolalo veľa očakávaní, keď bol sám Albert Einstein vo svojej teórii.
Broglieho teória však mala nedostatok, čo bolo v tom, že význam vlastnej myšlienky nebol veľmi dobre pochopený: elektrón môže byť vlnou, ale čo s tým, čo s tým? To je, keď sa zdá, že na číslo Schrödingera odpovedá.
Aby sa to dosiahlo.
Ďalej vedecké základy tohto atómového modelu:
Youngov experiment: prvá demonštrácia duality vlny-častíc
Broglieho hypotéza o zvlnenej a korpuskulárnej povahe subjektu môže byť demonštrovaná Youngovým experimentom, známym tiež ako experiment s dvojitou štrbinou.
Anglický vedec Thomas Young položil základy Schrödingerovho atómového modelu, keď v roku 1801 vykonal experiment na overenie zvlnenej povahy svetla.
Počas svojho experimentu mladý rozdelil emisiu lúča svetla, ktorý prechádza malú dieru cez pozorovaciu komoru. Toto rozdelenie sa dosiahne pomocou karty 0,2 milimetra, ktorá sa nachádza rovnobežne s lúčom.
Dizajn experimentu bol vytvorený pre ľahký lúč na širší ako karta, čím sa karta vodorovne umiestnila, lúč bol rozdelený na približne rovnaké časti. Výstup z svetelných lúčov bol režírovaný zrkadlom.
Môže vám slúžiť: sily na diaľkuOba lúče svetla zasiahli stenu v tmavej miestnosti. Tam bol dôkaz interferencie medzi týmito dvoma vlnami, čo sa ukázalo, že svetlo sa môže správať rovnako ako častica a vlna.

O storočie neskôr Albert Einsten túto myšlienku posilnil prostredníctvom princípov kvantovej mechaniky.
Schrödingerova rovnica
Schrödinger vyvinul dva matematické modely, čím odlišoval, čo sa stane v závislosti od toho, či sa kvantový stav v priebehu času mení alebo nie.
Pre atómovú analýzu, Schrödinger uverejnený koncom roku 1926.
To znamená, že vlna sa nepohybuje, jej uzly, to znamená, jej rovnovážny bod, slúžia ako otočenie pre zvyšok štruktúry, ktorá sa pohybuje okolo nich, a opisuje určitú frekvenciu a amplitúdu.
Schrödinger definoval vlny, ktoré opisujú elektróny ako stacionárne alebo orbitálne stavy a sú zase spojené na rôznych úrovniach energie.
Nezávislá časová rovnica Schrödingera je nasledovná:
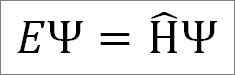
Kde:
A: Proporcionalita konštanta.
Ψ: Funkcia kvantovej vlny systému.
Η ̂: Hamiltonov operátor.
Nezávislá časová rovnica Schrödingera sa používa, keď pozorovateľná, ktorá predstavuje celkovú energiu systému, známy ako Hamiltonov operátor, nezávisí od času. Funkcia opisujúca celkový pohyb vlny bude však vždy závisieť od času.
Schrödingerova rovnica naznačuje, že ak máte vlnovú funkciu ψ a hamiltonov operátor na ňu pôsobí, proporcionálnosť konštanta a predstavuje celkovú energiu kvantového systému v jednom zo svojich stacionárnych stavov.
Môže vám slúžiť: diskrétna premenná: Charakteristiky a príkladyAplikované na Schrödingerov atómový model, ak sa elektrón pohybuje v definovanom priestore, existujú diskrétne energetické hodnoty a ak je elektrón voľne posunutý v priestore, mali sa kontinuálne energetické intervaly.
Z matematického hľadiska existuje niekoľko riešení pre Schrödingerovu rovnicu, každé riešenie znamená inú hodnotu pre konštantnú proporcionalitu a.
Podľa princípu neistoty Heisenberga nie je možné odhadnúť polohu alebo energiu elektrónu. Vedci preto uznávajú, že odhad polohy elektrónov v rámci atómu je nepresný.
Postuláty atómového modelu Schrödinger
Postuláty atómového modelu Schrödinger sú nasledujúce:
-Elektróny sa správajú ako stacionárne vlny, ktoré sú distribuované vo vesmíre podľa vlnovej funkcie ψ.
-Elektróny sa pohybujú vo vnútri atómu popisujúce orbitály. Toto sú oblasti, v ktorých je pravdepodobnosť nájdenia elektrónu podstatne vyššia. Vyššie uvedená pravdepodobnosť je úmerná štvorcovej vlnovej funkcii ψ2.
Elektronická konfigurácia atómového modelu Schrödinguer vysvetľuje periodické vlastnosti atómov a odkazov, ktoré sa tvoria.
Schrödingerov atómový model však neuvažuje o rotácii elektrónov a nezohľadňuje variácie rýchlych elektrónov v dôsledku relativistických účinkov v dôsledku relativistických účinkov.
Predmety záujmu
Broglie atómový model.
Atómový model Chadwick.
Heisenberg atómový model.
Perrin atómový model.
Thomson Atomic Model.
Atómový model Dalton.
Atómový model Dirac Jordan.
Atómový model demokritu.
Leucipo atómový model.
Bohr atómový model.
Sommerfeld atómový model.
Súčasný atómový model.
Odkazy
- Kvantový mechanický model atómu získaného z: je to.Khanacademy.orgán
- Schrödingerova vlnová rovnica (s.F.). Jaime I University. Castellón, Španielsko. Získané z: uji.je
- Moderná atómová teória: modely. © Abcte. Získané z: Abcte.orgán
- Schrodinger's Atomic Mod.F.). Získané z: Erwinschrodingerbiografie.Slečna.com
- Wikipedia, encyklopédia zadarmo. Schrödingerova rovnica. Obnovené z: je.Wikipedia.orgán
- Wikipedia, encyklopédia zadarmo. Experiment. Obnovené z: je.Wikipedia.orgán

