Broglie atómový model

- 4585
- 410
- Ing. Ervín Petruška
On Broglie atómový model Navrhol ho francúzsky fyzik Louis Broglie v roku 1924. Vo svojej dizertačnej práci Broglie uviedol, že dualita elektrónov vĺn sa kladie základy zvlnenej mechaniky. Broglie publikoval dôležité teoretické nálezy o prírode vlny-corpusculus.
Následne Broglieho vyhlásenia boli experimentálne demonštrované vedcami Clinton Davisson a Lester Germer v roku 1927. Teória vĺn elektrónov Broglie je založená na Einsteinovom návrhu na zvlnené vlastnosti svetla v krátkych vlnových dĺžkach.
 Louis Broglie
Louis Broglie Broglie oznámil možnosť, že hmota mala správanie podobné správaniu svetla, a navrhla podobné vlastnosti v subatomických častiach, ako sú elektróny.
Elektrické a obežné zaťaženia obmedzujú amplitúdu, dĺžku a frekvenciu vlny opísanej elektrónmi. Broglie vysvetlil pohyb elektrónov okolo atómového jadra.
[TOC]
Charakteristiky atómového modelu Broglie
Na rozvoj svojho návrhu začal Broglie z princípu, že elektróny mali medzi vlnou a časticami duálnu povahu, podobne ako svetlo.
V tomto zmysle sa Broglie stal podobným medzi dvoma javmi a na základe rovníc vyvinutých Einsteinom na štúdium zvlnenej povahy svetla, uviedol:
- Celková energia fotónu a následne celková energia elektrónu je výsledkom produktu frekvencie vlny a doskovej konštanty (6 62606957 (29) × 10 -3. 4 Jules x sekundy), ako je uvedené v nasledujúcom výraze:

V tomto výraze:
E = elektrónová energia.
H = doska konštanta.
F = frekvencia vlny.
- Lineárny moment fotónu, a preto elektrón, je nepriamo úmerný dĺžke vlny a oba veľkosti sú spojené cez doskovú konštantu:
Môže vám slúžiť: reverzná osmóza: ako to funguje, na čo je, príklady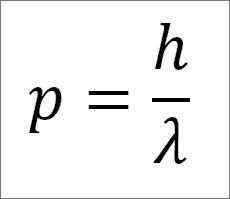
V tomto výraze:
P = lineárny moment elektrónu.
H = doska konštanta.
λ = vlnová dĺžka.
- Lineárny moment je produktom hmotnosti častíc v dôsledku rýchlosti, ktorá má uvedená častica počas jej posunu.
Ak je predchádzajúci matematický výraz reštrukturalizovaný v závislosti od vlnovej dĺžky, nasleduje:
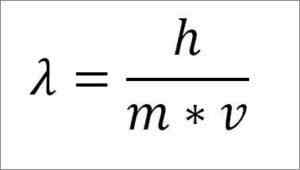
V tomto výraze:
λ = vlnová dĺžka.
H = doska konštanta.
M = elektrónová hmota.
V = Elektrónová rýchlosť.
Pretože h, dosková konštanta, má malú hodnotu, je tiež vlnová dĺžka λ. V dôsledku toho je možné uviesť, že vlny vlastnosti elektrónu sú prezentované iba na atómových a subatomických hladinách.
- Broglie je tiež založený na postulátoch atómového modelu Bohr. Podľa posledného menovaného sú obežné dráhy elektrónov obmedzené a môžu byť iba násobkami celých čísel. Tak:
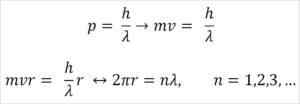
Kde:
λ = vlnová dĺžka.
H = doska konštanta.
M = elektrónová hmota.
V = Elektrónová rýchlosť.
R = polomer obežnej dráhy.
n = celé číslo.
Podľa Bohrovho atómového modelu, do ktorého Broglie prijal ako základ, ak sa elektróny správajú ako stacionárne vlny, jediné povolené dráhy sú tie, ktorých polomer sa rovná celému násobku vlnovej dĺžky λ.
Preto nie všetky obežné dráhy dodržiavajú potrebné parametre pre elektrón na mobilizáciu týmto. Preto sa elektróny môžu pohybovať iba na konkrétnych dráhach.
Teória vĺn Broglieho elektrónov odôvodnila úspech Bohrovho atómového modelu na vysvetlenie jedinečného elektrónového správania atómu vodíka.
Môže vám slúžiť: suchú batériuPodobne tiež dal svetlá, prečo sa tento model nepripravoval na zložitejšie systémy, tj atómy s viac ako jedným elektrónom.
Experiment Davisson a Germer
Experimentálna kontrola atómového modelu Broglie sa uskutočnil o 3 roky neskôr od jeho publikácie v roku 1927.
Prominentní americkí fyzici Clinton J. Davisson a Lester Germer experimentálne potvrdili teóriu zvlnenej mechaniky.
Davisson a Germer vykonali disperzné testy elektrónového lúča cez kryštál niklu a pozorovali jav difrakcie cez kovové prostredie.
Vykonaný experiment pozostával z vykonávania nasledujúceho postupu:
- V prvom prípade bola umiestnená zostava s elektrónovým lúčom, ktorá mala známu počiatočnú energiu.
- Bol nainštalovaný zdroj napätia na urýchlenie pohybu elektrónov, ktorý podnecuje potenciálny rozdiel.
- Tok elektrónového lúča do kovového skla bol nasmerovaný; V tomto prípade nikel.
- Meral sa počet elektrónov, ktoré zasiahli niklové sklo.
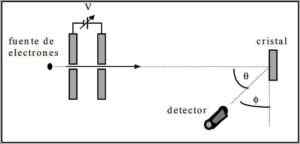
Na konci experimentovania Davisson a Germer zistili, že elektróny sa rozptýlili rôznymi smermi.
Pri opakovaní experimentu pomocou kovových kryštálov s rôznymi orientáciami vedci zistili nasledujúce:
- Disperzia elektrónového lúča kovovým sklom bola porovnateľná s javom interferencie a difrakcie svetelných lúčov.
- Odraz elektrónov na nárazovom skle opísal trajektóriu, ktorá by sa teoreticky mala opísať podľa teórie elektrónových vĺn Broglie.
Stručne povedané, experimenty Davisson a Germer Experimentálne preukázali povahu elektrónov s dvojitou vlnovou časticou.
Môže vám slúžiť: Polárny kovalentný odkaz: Charakteristiky a príkladyObmedzenia
Broglieho atómový model nepredpovedá presné umiestnenie elektrónu na obežnej dráhe, v ktorej sa pohybuje.
V tomto modeli sú elektróny vnímané ako vlny, ktoré sú mobilizované na celej obežnej dráhe bez konkrétneho miesta, čo predstavuje koncept elektronického orbitálu.

Broglieho atómový model, analogický modelu Schrödinger, okrem toho nezohľadňuje rotáciu elektrónov na tej istej osi (točiť sa).
Ignorovaním vnútornej uhlovej hybnosti elektrónov sa priestorové variácie týchto subatomických častíc ponechajú stranou.
V rovnakom poradí nápadov tento model tiež nezohľadňuje zmeny v správaní rýchlych elektrónov v dôsledku relativistických účinkov.
Predmety záujmu
Schrödinger atómový model.
Atómový model Chadwick.
Heisenberg atómový model.
Perrin atómový model.
Thomson Atomic Model.
Atómový model Dalton.
Atómový model Dirac Jordan.
Atómový model demokritu.
Leucipo atómový model.
Bohr atómový model.
Súčasný atómový model.
Odkazy
- Bohrova kvantová teória a de Broglie vlny (s.F.). Získané z: ne.Fyzický.Kyushu-u.Ac.J
- Louis de Broglie - Biographical (1929). © Nobelova nadácia. Získané z: Nobelprize.orgán
- Louis-Victor de Broglie (S.F.). Zdroj: Chemed.Chem.Purdue.Edu
- Lovett, B. (1998). Louis de Broglie. Encyclopædia Britannica, Inc. Získané z: Britannica.com
- De Broglie atómový model. Národná univerzita dištančného vzdelávania. Španielsko. Získané z: OCW.Inovácia.Udelený.je
- Louis de Broglie.F.). Získané z: Hiru.Eus
- Von Pamel, alebo., A Marchisio, s. (s.F.). Kvantová mechanika. Národná univerzita v Rosario. Zotavené z: fceia.r.Edu.ar

