Súčasný atómový model

- 2905
- 258
- MUDr. Miloslav Habšuda
Aký je súčasný atómový model?
On Súčasný atómový model Je to založená na kvantovej mechanike, najmä v Schrödingerovej rovnici, v zásade vylúčenia Pauliho a vlastnosti elektrónu s názvom točiť sa ani Espin.
Je to model najväčšieho prijatia a použitia pri štúdiu štruktúry atómov, molekúl a chemickej reaktivity prvkov z dôvodu presnosti ich predpovedí a ich relatívnej jednoduchosti.
 postava 1. Atóm vodíka v vzrušenom stave a jeho atómové čísla: Energia n = 4, uhlová hybnosť L = 3 a magnetický moment m = 1. Zdroj: Wikimedia Commons.
postava 1. Atóm vodíka v vzrušenom stave a jeho atómové čísla: Energia n = 4, uhlová hybnosť L = 3 a magnetický moment m = 1. Zdroj: Wikimedia Commons. Tento model je vývojom niekoľkých predchádzajúcich atómových modelov, ako je model Rutherford a model Bohr - Sommerfeld, považovaný za klasické alebo semiklasické modely.
V súčasnosti existujú teoreticky úplnejšie modely ako Schrödingerov typisický model, ako napríklad model Dirac-Jordan, ktorý obsahuje špeciálnu relativitu a je založený na rovnici Dirac Wave Rovnica. V tejto rovnici sa samozrejme javí rotácia, vlastnosť elektrónov uvedených na začiatku.
Existujú aj modely založené na teórii kvantového poľa, ktoré sa uplatňujú vo fyzike s vysokou energiou. Tieto modely sú vynikajúce v predikcii tvorby a zničenia základných častíc, cieľ tejto oblasti fyziky.
Za zmienku stojí, že najsofistikovanejšie teórie sa zbiehajú na rovnaké výsledky ako výsledky Schrödingerovej rovnice, najmä pre atómy svetla.
Súčasné charakteristiky atómového modelu
Vo vízii súčasného atómu, založeného na nelativistickom kvante, neexistuje koncept elektronických dráh v štýle planétových systémov.
Najrozšírenejším obrazom atómu je však stále obraz kladného centrálneho jadra a niektorých negatívnych bodov elektrického náboja (elektróny), ktoré sa otáčajú dokonale definované obežné dráhy okolo centrálneho jadra. Ale napriek svojim koreňom už nezodpovedá súčasnému atómovému modelu.
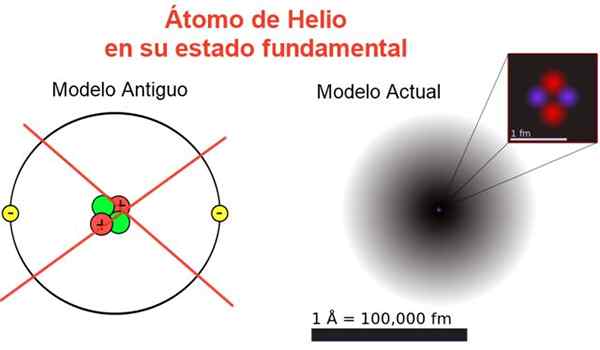 Obrázok 2. Klasický a aktuálny obraz atómu hélia v jeho základnom stave. V súčasnom modeli sú dva elektróny atómu hélia rozptýlené v oblasti zvanej orbitálna. Zdroj: Wikimedia Commons, vaše vlastné zloženie.
Obrázok 2. Klasický a aktuálny obraz atómu hélia v jeho základnom stave. V súčasnom modeli sú dva elektróny atómu hélia rozptýlené v oblasti zvanej orbitálna. Zdroj: Wikimedia Commons, vaše vlastné zloženie. Obrázok 2 zobrazuje starý obraz a aktuálny obraz atómu hélia v jeho menšom energetickom stave (úroveň n = 1 a l = 0).
Môže vám slúžiť: Priemerné zrýchlenie: Ako sa vypočítava a vyriešiKlasický obrázok je užitočný na zistenie, že jadro obsahuje dva protóny a dva neutróny. Zaručovanie neutrality atómu Existujú dva elektróny, ktoré zaberajú rovnakú úroveň energie.
Z zvyšku je to obraz mimo reality, pretože mierka jadra nezodpovedá ani atómu: jadro je 1/100 000 -násobok veľkosti atómu, ale tam sa koncentruje atómová hmota.
Dualita ONDA - častice
Klasická mechanika ustanovuje, že každá materiálová častica má pridruženú vlnu, ktorá sa nazýva Vlnová funkcia. Toto je slávny Dualita z Louis de Broglie.
V súčasnom atómovom modeli je správanie elektrónu v mierke atómov výrazne zvlnené, zatiaľ čo na makroskopickej úrovni, ako sú elektróny, ktoré sa pohybujú v trubiciach katódového lúča starých televízorov, prevažuje korpuskulárne správanie.
Na druhej strane, s fotónmi sa to stáva naopak, vo väčšine optických javov (na makroskopickej úrovni) majú zásadne zvlnené správanie. A keď interagujú s hmotami, majú správanie častíc.
Z tohto dôvodu sú elektróny okolo jadra rozptýlené do oblastí nazývaných atómové orbitály, ktorého tvar a rozšírenie budú závisieť od úrovne energie elektrónov a uhlovej hybnosti.
Energia a uhlová hybnosť elektrónu okolo jadra majú určité povolené hodnoty, preto sa hovorí, že sú kvantifikovaný.
Rovnica Schrödingerovej vlny predpovedá, ktoré energetické hodnoty a uhlová hybnosť sú povolené, ako aj vlnová funkcia spojená s každou úrovňou energie a hybnosti.
Matematický štvorec vlnovej funkcie určuje orbitály, to znamená, oblasti okolo jadra, kde je možné nájsť elektróny.
Veľkosť atómu
Ak chcete mať mierku obrazu súčasného atómového modelu, predstavme si, že atóm má priemer, ako je písmeno futbalového poľa. Jadro by bolo ako mravec v strede poľa, ale prekvapivo s 99,9% atómovej hmoty.
Na druhej strane, elektróny by boli rovnako rozptýlení strašidelných hráčov po celom poli, s väčšou pravdepodobnosťou, že sa nachádzajú v strede poľa.
Môže vám slúžiť: kategorická premenná: Charakteristiky a príkladyExistuje niekoľko zarovnaní alebo povolených spôsobov, ako obsadiť pole, ktoré závisia od energie hráčov (elektrónov) a množstva „zákruty“ alebo točenia okolo stredu.
Súčasné postuláty atómového modelu
1.- Elektrón sa vyznačuje jeho hmotnosťou m, jeho rotáciou siež A za to, že sú častice nosiča elementárneho záporného zaťaženia (-e).
2.- Elektróny majú dvojité správanie v tvare vlny, ale v závislosti od ich energie a rozsahu fenoménu môže byť prevažne prevahacie ako druhý.
3.- Elektróny obklopujú pozitívne atómové jadro, takže zaručujú elektrickú neutralitu atómu. Množstvo elektrónov sa preto rovná množstvu protónov; To je atómové číslo, ktoré udeľujú chemické a fyzikálne vlastnosti každého prvku.
4.- Interakcia medzi elektrónmi a jadrom je modelovaná podľa potenciálu V (r) Coulombova elektrostatická, ktorá je začlenená do termínu potenciálnej energie v hamiltonovskom operátorovi.
5.- Termín kinetickej energie v hamiltonovskom operátorovi je operátor, ktorý je postavený z operátora lineárnej hybnosti, je rovnaký:
p = - i ħ ∂ /∂r
Kde ħ je Planckova konštanta vydelená 2π.
6.- Hamiltonov operátor H = (P zajtra/2m - E V (r) pôsobiť na funkciu elektrónovej vlny ψ (r).
7.- Keď sa hľadajú stacionárne riešenia funkcie elektronickej vlny, používa sa nezávislá Schrödingerova rovnica času:
H ψ (r) = E ψ (r)
Kde E predstavuje celkovú energiu elektrónu.
8.- V atómoch s niekoľkými elektrónmi sa interakcia medzi nimi nezohľadňuje.
9.- Pokiaľ ide o atómy mnohých elektrónov, orbitály najvzdialenejších elektrónov sú modelované podľa potenciálu tieneného jadra pomocou najviac vnútorných elektrónov, ktoré sú známe ako Debye Potenciál.
10.- Rovnica (7) má riešenie pre niektoré diskrétne energetické hodnoty, takže celebrity Koľko z Planck, Prirodzene sa objavujú zo Schrödingerových rovníc riešení.
Môže vám slúžiť: stacionárne vlny: vzorce, charakteristiky, typy, príkladyjedenásť.- Pre každú diskrétnu hodnotu existuje vlnová funkcia. Ale niektoré roztoky sú degenerované v závislosti od hodnoty uhlovej hybnosti l.
12.- Vlnová funkcia je produktom radiálnej funkcie, azimutálnej funkcie a polárnej funkcie.
13.- Táto vlnová funkcia určuje povolené oblasti pre elektrón. Štvorec vlny funkcie je hustota pravdepodobnosti Nájsť elektrón v určitej polohe, vidieť zo stredu atómového jadra.
14.- Spin sa neobjavuje v Schrödingerovej rovnici, ale je začlenená do atómového modelu prostredníctvom Pauliho princípu:
Elektrón je fermion s dvoma možnými stavmi rotácie +½ a -½.
Takže ten istý stav charakterizovaný kvantovými číslami n, l, m Schrödingerovej rovnice, môže byť najviac obsadený 2 elektrónmi s protikladmi protikladmi protikladmi. Týmto spôsobom sa ESPIN stáva štvrtým kvantovým číslom.
Vplyvní vedci v súčasnom atómovom modeli
Vyzerá to neuveriteľné, ale väčšina fyzikov, ktorí prispeli k súčasnému atómovému modelu, sa objaví na tej istej fotografii. Zišli sa na slávnych konferenciách sponzorovaných Ernestom Solvayom, chemikom a priemyselným belgickým pôvodom, ktorý sa stal slávnym vo svete vedy.
Začali sa konať od roku 1911 a spájali najväčších vedcov v tejto chvíli, medzi nimi boli prakticky všetci, ktorí prispeli k súčasnému atómovému modelu.
Najslávnejšie z týchto konferencií sa konalo v Bruseli v roku 1927 a tam bola urobená táto historická fotografia:
 Obrázok 3. 1927 Účastníci konferencie Solvay v Bruseli. Zdroj: Wikimedia Commons.
Obrázok 3. 1927 Účastníci konferencie Solvay v Bruseli. Zdroj: Wikimedia Commons.  Obrázok 4. Účastníci konferencie Solvay 1927.
Obrázok 4. Účastníci konferencie Solvay 1927. - Peter Debye
- Irving Langmuir
- Martin Knudsen
- Auguste Piccard
- Max Planck
- William Lawrence Bragg
- Émile Henriot
- Paul Ehrenfest
- Marie Curie
- Hendrik Anthony Kramers
- Édouard Herzen
- Hendrik Antoon Lorentz
- Théofile
- Paul Adrien Maurice Dirac
- Albert Einstein
- Erwin Schrödinger
- Arthur Holly Compton
- Jules Temle Verschaffelt
- Paul Langevin
- Louis-Victor de Broglie
- Charles-Eugène Guye
- Wolfgang Pauli
- Werner Heisenberg
- Max narodený
- Charles Thomson Rees Wilson
- Ralph Howard Fowler
- Léon Billouin
- Niels Bohr
- Owen Williams Richardson
Predmety záujmu
Schrödinger atómový model.
Broglie atómový model.
Atómový model Chadwick.
Heisenberg atómový model.
Perrin atómový model.
Thomson Atomic Model.
Atómový model Dalton.
Atómový model Dirac Jordan.
Atómový model demokritu.
Leucipo atómový model.
Bohr atómový model.
Odkazy
- Alonso - Finn. Kvantové a štatistické základy. Addison Wesley.
- Bauer, w. 2011. Fyzika pre inžinierstvo a vedy. Zväzok 1. MC Graw Hill.
- Eisberg a Resnick. Kvantová fyzika. Limusa - Wiley.
- Wikipedia. Atómová teória. Obnovené z: je.Wikipedia.com
- Zapata f. Tylokuantický model atómu. Zdroj: Lifer.com

