Quiraral Rankic Mixture, príklady
- 3821
- 892
- Adrián Fajnor
A Mravná zmes o Racmatics je to, čo sa skladá z dvoch enantiomérov v rovnakých častiach, a preto je opticky neaktívny. Táto optická aktivita sa týka schopnosti jeho riešení otáčania, v harmonograme alebo proti líčeniu, lúč polarizovaného svetla, ktorý cez ne prechádza smerom v smere.
Enantiomér má schopnosť otáčať polarizované svetlo, povedzme, doľava (Levógiro), takže jeho čisté riešenie bude opticky aktívne. Ak sa to však začne pridávať enantiomér, ktorý otáča svetlo doprava (dextrogyry), jeho optická aktivita sa zníži, kým sa neaktivuje.
 Klastre na hrozno, ktoré zdieľajú príbuzenstvo s Rankickými zmesami za etymológiou. Zdroj: pexels.
Klastre na hrozno, ktoré zdieľajú príbuzenstvo s Rankickými zmesami za etymológiou. Zdroj: pexels. Keď sa to stane, hovorí sa, že existujú rovnaké množstvá ako Levogiro a Dextrógiro enantiomers; Ak molekula rozbije polarizované svetlo doľava, jeho účinok sa okamžite zruší, keď je „zakopnuté“ s inou molekulou, ktorá ho otáča doprava. A tak ďalej. Preto budeme mať RANKICKÁ zmes.
Prvé pozorovanie vylepšenia urobilo francúzsky chemik Louis Pasteur v roku 1848, ktorý študoval zmes enantiomérnych kryštálov kyseliny z kamínovej (do tej doby nazývanej kyselina Rank). Keď táto kyselina z hrozna používaného na výrobu vína, táto zmes skončila všeobecným spôsobom pre všetky molekuly.
[TOC]
Topánky a chiralita
V prvom rade je tu argumentačná zmes, musia existovať dva enantioméry (obyčajné), čo naznačuje, že obe molekuly sú chirály a že ich zrkadlové obrazy nie sú prekrývateľné. Pár topánok to dokonale ilustruje: bez ohľadu na to, do akej miery sa ľavá topánka pokúša vpravo, nikdy sa nemôžu zmestiť.
Môže vám slúžiť: slabá kyselinaPravá topánka, povedzme, odkloní polarizované svetlo doľava; Kým ľavá topánka to robí vpravo. V hypotetickom riešení, kde sú topánky molekuly, ak existujú iba topánky pre práva, chirals, bude to opticky aktívne. Rovnakým spôsobom sa to stane, ak v riešení sú iba ľavá topánky.
Ak však existuje tisíc ľavých topánok zmiešaných s tisíckou obuvou práva, potom je tu Rankická zmes, ktorá je tiež opticky neaktívna, pretože odchýlky, ktoré trpia svetlom vo vnútri, sú vzájomne zrušené.
Keby to namiesto topánok boli gule, objekty, ktoré sú akvirálne, bolo by pre nich nemožné existovať s nimi, pretože by ani neboli schopní existovať ako enantiomérne páry.
Príklady
Kyselina vínna
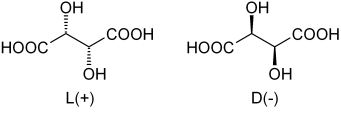 Enantimery kyseliny z tatárovej. Zdroj: Dschanz [verejná doména]
Enantimery kyseliny z tatárovej. Zdroj: Dschanz [verejná doména] Po návrate do kyseliny z tatárovej sa jej zmes Rankic Actle stretla ako prvá, ktorá sa stretla. Na hornom obrázku sú znázornené jeho dva enantioméry, z ktorých každý je schopný tvoriť kryštály s morfologickými tvárami „ľavého“ alebo „doprava“. Pasteur, pomáhaním mikroskopu a prísnemu úsiliu, sa podarilo oddeliť tieto enantiomérne kryštály od seba navzájom.
Kryštály enantiomérov L (+) a D (-) osobitne predstavujú optickú aktivitu odklonením polarizovaného svetla doprava alebo doľava. Ak sa oba kryštály v rovnakých molárnych pomeroch rozpustia vo vode, získa sa opticky neaktívna Rankická zmes.
Všimnite si, že oba enantioméry majú dva chirálne uhlíky (so štyrmi rôznymi substituentmi). V L (+) sú OH za rovinou tvorenou uhlíkovou kostrou a skupinami COOH; Zatiaľ čo v d (-) sú tieto OH vyššie uvedené lietadlo.
Tí, ktorí syntetizujú kyselinu z hmlistej. Na oddelenie enantioméru L (+) od d (-) je potrebné királne rozlíšenie, v ktorom táto zmes reaguje s chirálnou bázou, čím sa vytvorí solí diasteroizoméru, ktoré sú schopné separovať frakčnou kryštalizáciou.
Môže vám slúžiť: Sulfid meďnatého: Štruktúra, vlastnosti, použitieQuinín
 Štrukturálna kostra molekuly chinínu. Zdroj: Benjah-Bmm27.
Štrukturálna kostra molekuly chinínu. Zdroj: Benjah-Bmm27. V predchádzajúcom príklade, aby sme sa označili za hodnostnú zmes kyseliny z tartarovej. V prípade chinínu (vynikajúci obraz) to bude (±) -chinina.
Izoméria chinínu je zložitá: má štyri chirálne uhlíky, čo vedie k šestnástim diasteriánom. Zaujímavé je, že dva z jeho enantiomérov (jeden s OH nad rovinou a druhý pod ňou) sú v skutočnosti diasttelisoméry, pretože sa líšia v konfiguráciách svojich ostatných chirálnych uhlíkov (bicyklov s atómom N).
Teraz je ťažké špecifikovať, ktorý zo stereoizomérov chinínu odvráti polarizované svetlo doprava alebo doľava.
Talidomid
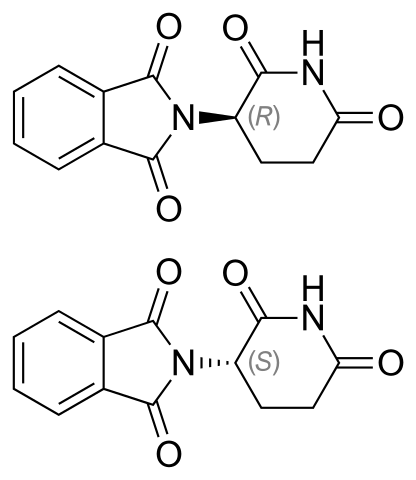 Taidomid enantimers. Zdroj: Vakcinácia [verejná doména]
Taidomid enantimers. Zdroj: Vakcinácia [verejná doména] Enantioméry talidomidu sú uvedené vyššie. Má iba quirálny uhlík: ten, ktorý je spojený s dusík, ktorý spája oba krúžky (jeden z ftalimida a druhý z gluteramidu).
V enantioméri R (so sedatívnymi vlastnosťami) je prsteň ftalimida (ten vľavo) orientovaný nad rovinou; zatiaľ čo v enantioméroch (s mutagénnymi vlastnosťami), pod nimi.
Percento z týchto dvoch nie je známe, ktoré z týchto dvoch odvádza svetlo doľava alebo doprava. Je známe, že zmes 1: 1 alebo 50% oboch enantiomérov tvorí Rankic Mix (±) -talidomid.
Ak chcete predávať iba talidomid ako hypnotický sedatívum, je povinné predložiť svoju radovú zmes do už spomínaného chirálneho rozlíšenia, takže sa získa čistý enantiomér.
Môže vám slúžiť: kvartérne zlúčeniny: Charakteristiky, školenie, príklady1,2-epoxipropán
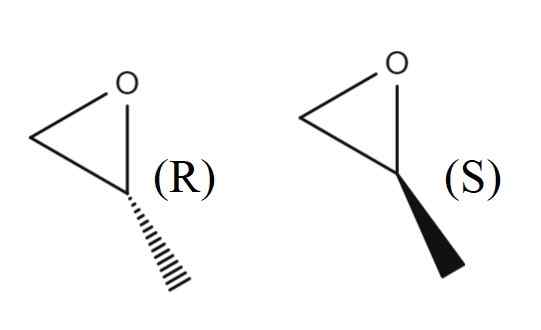 1,2-epoxipropánske enantioméry. Zdroj: Gabriel Bolívar.
1,2-epoxipropánske enantioméry. Zdroj: Gabriel Bolívar. Na hornom obrázku máte pár enantiomérov 1,2-epoxipropano. Enantiomer R odvádza polarizované svetlo doprava, zatiaľ čo S ho odvádza doľava; To znamená, že prvý je (r)-(+)-1,2-epoxipropano a druhý (s)-(-)-1,2-epoxipropano.
Rankická zmes z nich dva, opäť v pomere 1: 1 alebo 50%, sa stáva (±) -1,2 -epoxipropán.
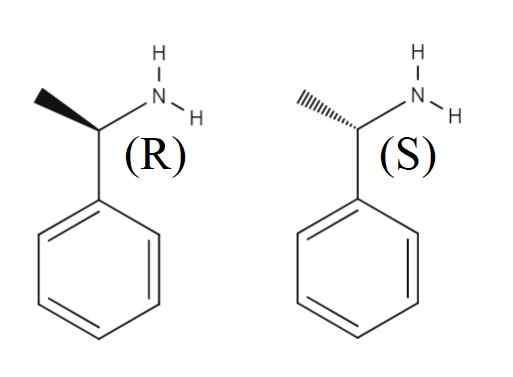
1-fenyletylamín
 Enantioméry 1-penyletylamínu. Zdroj: Gabriel Bolívar.
Enantioméry 1-penyletylamínu. Zdroj: Gabriel Bolívar. Zobrazuje sa horná iná hodnostná zmes tvorená dvoma enantiomérmi 1-feniletylamínu. Enantiomér R je (R)-(+)-1-fenyletylamín a enantiomér S (s)-(-)-1-feniletilamín; Jeden má metylovú skupinu, Cho3, ukazovanie mimo aromatického kruhového lietadla a druhé smerujúce pod týmto.
Všimnite si, že keď je konfigurácia R, niekedy sa zhoduje s skutočnosťou, že enantiómero otáča polarizované svetlo doprava; Nie vždy sa to neuplatňuje a nemôže sa brať ako všeobecné pravidlo.
Konečný komentár
Dôležitejšie ako existencia alebo nie z radových zmesí je chirálne rozlíšenie. Platí to najmä pre zlúčeniny s farmakologickými účinkami, ktoré závisia od takýchto stereoizómov; To znamená, že enantiomér môže byť pre pacienta prospešný, zatiaľ čo druhý ho môže ovplyvniť.
Z tohto dôvodu sa tieto chirálne rozlíšenie uchýli k oddeleniu Rankických zmesí v ich zložkách, a preto ich dokážu predávať ako čisté drogy bez škodlivých nečistôt.
Odkazy
- Morrison, r. Tón. a Boyd, R, N. (1987). Organická chémia. 5. vydanie. Redakčný Addison-Wesley Inter-American.
- Carey F. (2008). Organická chémia. (Šieste vydanie). MC Graw Hill.
- Graham Solomons t.W., Craig B. Fryhle. (2011). Organická chémia. Amín. (10. vydanie.). Wiley Plus.
- Steven a. Hardinger. (2017). Ilustrovaný glosár organickej chémie: racemická zmes. Oddelenie chémie a biochémie, UCLA. Získané z: Chem.UCLA.Edu
- Nancy Devino. (2019). Racemická zmes: Definícia a príklad. Štúdium. Získané z: štúdie.com
- James Ashenhurst. (2019). Stereochémia a chiralita: Čo je racemická zmes? Získané z: Masterorganicchemistry.com
- John C. Leffingwell. (2003). Chiralita a biologická aktivita i.: Farmakológia. [PDF]. Získané z: Leffingwell.com

