Alkalické kovy fyzikálne a chemické vlastnosti, použitie, získanie
- 2079
- 267
- Tomáš Klapka
Ten alkalické kovy Toto sú prvky, ktoré sú súčasťou skupiny I periodickej tabuľky, s výnimkou vodíka: lítia (Li), sodný (NA), draslík (k), rubidid. Na rozdiel od väčšiny kovov majú nízku hustotu a sú veľmi reaktívne. Kvôli tejto veľkej chemickej reaktivite sa nikdy nenachádzajú v prírode vo svojej základnej podobe.
Tieto kovy tvoria jednoduché a stabilné iónové zlúčeniny, ktoré sú väčšinou rozpustné vo vode; Alkalické kovy sa zvyčajne kombinujú s iónmi halogenidu, síranom, uhličitanom a kremičitanmi. Niektoré prvky však tvoria obmedzený počet komplexných a organometálnych zlúčenín.

Všeobecne platí, že fyzikálne a chemické vlastnosti alkalických kovov boli dobre preštudované, s výnimkou Franca kvôli jeho rádioaktívnej povahe.
[TOC]
Fyzikálne vlastnosti
- Alkalické kovy sú striebro, s výnimkou cézie, ktoré je zlaté. Vykonávajú elektrinu a teplo a majú nízke body topenia, ktoré sa tiež znižujú so zvýšením atómového počtu, pretože spojenie medzi atómami je oslabené zvýšením atómového polomeru.
- Skutočnosť, že ATOM má iba jeden elektrón Valencie. V dôsledku.
- Všetky prvky prijímajú kubickú štruktúru sústredenú na tele. Pretože tento typ kryštalickej štruktúry nie je zabalený a atómové rádiá alkalických kovov sú veľké, majú nízku hustotu v porovnaní s inými kovmi. V skutočnosti je lítium, sodík a draslík plávajúce vo vode.
- Energetické rozdiely medzi orbitálmi valencia vrstvy alkalických kovov sa zhodujú s vlnovými dĺžkami viditeľného svetla. Z tohto.
Môže vám slúžiť: trinitrotolueno (TNT): štruktúra, vlastnosti, použitia, riziká, výbuch- V zostupnom poradí dodávajú lítium soli karmínovú farbu, sodné soli žltú farbu, draslík Fialová farba, rubídium moderou červenou farbou a prestanú modrú farbu.
Chemické vlastnosti
Všetky alkalické kovy majú vo svojich chemických vlastnostiach podobnosť.
- Majú elektronickú konfiguráciu Valencia NS1, ktorá sa premieta do oxidačného stavu +1. To znamená, že ľahko stratia elektrón na dosiahnutie konfigurácie šľachtického plynu.
- Všeobecne platí, že alkalické kovy majú najnižšiu ionizačnú energiu všetkých prvkov, ktoré sa tiež znižujú so zvyšujúcim sa atómovým polomerom v skupine, pretože vrstva Valencie je čoraz viac vzdialená od jadra. To vysvetľuje reaktivitu alkalických kovov a tvorbu m+ iónov v ľahko vodných podmienkach.
- Termodynamická tendencia tvoriť m+ ióny je potvrdená štandardnými potenciálmi párov M+/M, ktoré sú všetky veľké a negatívne. Takýto trend naznačuje, že alkalické kovy ľahko oxidujú a môžu pôsobiť ako silné redukčné látky.
- Tieto prvky sa musia skladovať v nereaktívnom oleji, aby sa predišlo reakcii s atmosférickým kyslíkom. Aj keď je lítiom, sodík a draslík manipulované vo vzduchu na krátke obdobia, rubídium a cesium sa musia zaobchádzať pod inertnou atmosférou vždy.
Získanie alkalických kovov
Sodík

Najlepší spôsob, ako získať kovový sodík, zahŕňa elektrolýzu chloridu roztaveného sodného. Pretože bod topenia chloridu sodného je pomerne vysoký (808 ° C) a na udržanie veľkého množstva roztavenej látky (CACL2) sa zvyčajne pridáva veľa energie, chlorid vápenatého (CACL2) sa obvykle pridáva, aby sa znížil bod topenia na približne 600 ° C.
Môže vám slúžiť: turbidimetriaSodík sa získava v kvapalnom stave v katóde s čistotou 99,95% pod inertnou atmosférou.
Lítium a draslík
Lítium sa dá získať aj z jeho chloridov odlievaných elektrolýzou, ale nie je to prípad draslíka, pretože je príliš rozpustný v chloridu (KCL) a nepláva sa na povrchu bunky. Okrem toho sa ľahko odparuje k prevádzkovej teplote, takže vytvára nebezpečné podmienky.
Preto sa draslík získava znížením roztaveného KCl kvapalným sodným. Sodík prítomný v draslíku je eliminovaný kondenzáciou pary pri 892 ° C a vykonaním frakčnej destilácie kvapalých kovov.
Rubidio a Cesio
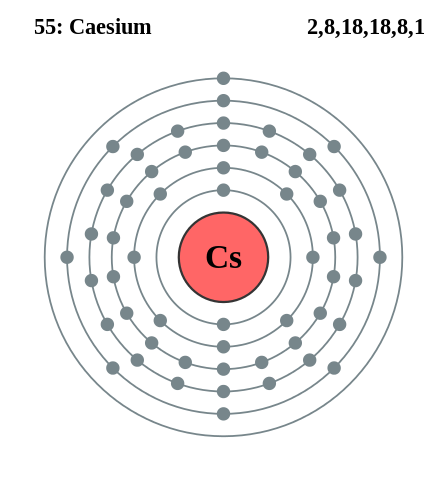 Elektronická konfigurácia Cesium. Zdroj: Pumbaa (originálna práca Grega Robsona) / CC BY-SA 2.0 UK (https: // creativeCommons.Org/licencie/By-SA/2.0/UK/skutok.v)
Elektronická konfigurácia Cesium. Zdroj: Pumbaa (originálna práca Grega Robsona) / CC BY-SA 2.0 UK (https: // creativeCommons.Org/licencie/By-SA/2.0/UK/skutok.v) Rubidio a cézium sa dajú získať podobne, ale použitie vápnika ako redukčného činidla. Kovový pobrežie sa môže získať aj pomocou roztaveného kyanidového kyanidu Cesium (CSCN).
Hlavné použitia a aplikácie
Sodík ako redukčné činidlo
Pretože sodík je veľmi ľahko oxidovaný, jeho najdôležitejšou aplikáciou je redukčné činidlo, aby sa získali kovy, ako sú titán, surround a hafnio. Používa sa tiež ako výmenník tepla v jadrových reaktoroch vo svojom kvapalnom stave.
Draslík ako hnojivo
 Chlorid draselného, hnojivo. Zdroj: Abbas cucaniensis/cc BY-SA (https: // creativecommons.Org/licencie/By-SA/4.0)
Chlorid draselného, hnojivo. Zdroj: Abbas cucaniensis/cc BY-SA (https: // creativecommons.Org/licencie/By-SA/4.0) Väčšina spracovaných draslíka ide do hnojív vo forme chloridu draselného. Chlorid sa zase používa pri výrobe iných zlúčenín a roztokov, ako je hydroxid draselný, ktorý sa používa pri výrobe tekutých mydiel.
Kyanid draselný sa používa na extrakciu alebo povlak kovu na uľahčenie depozície meďnatého, striebra a zlata. Draslík sa nachádza aj v niektorých výbušninách a ako farbivo z ohňostroja.
Môže vám slúžiť: Rádio: Štruktúra, vlastnosti, použitie, získanieLítium ako agent zliatiny
Metalické lítia sa používa ako zliatinové činidlo pri výrobe leteckých a leteckých zliatin hliníka a horčíka a leteckého zliatiny. Ale s plynutím času zistil, že rastúca užitočnosť ako anóda alkalickej batérie.
Kovové lítia tiež umožňuje znížiť teplotu topenia a spekania určitých typov skla a keramiky, okrem zníženia jeho koeficientu expanzie. Uhličitan lítium sa široko používa na liečbu bipolárnych podmienok, zatiaľ čo lítium stearát je mazivo široko používané v automobilovom priemysle.
Rubidio a Cesio
Rubidio a cézium sa zvyčajne používajú v rovnakých aplikáciách, takže jeden z týchto prvkov môže byť nahradený druhým. Aplikácie zahŕňajú optické sklo v telekomunikačnom priemysle, vybavenie nočného videnia a fotoelektrické bunky. Hodiny Cesio (atómové hodiny) sa používajú pre medzinárodné štandardné časové opatrenie a pre definíciu druhého.
Odkazy
- Chang, R., & Goldsby, K. Do. (2016). Chémia (12. vydanie.). New York: MC-Graw Hill.
- Halka, m., & Nordstrom, B. (2010). Alkalické a alkalické kovy Zeme. New York: Publikovanie Infobase.
- Miesler, G. L., Fischer, P. J., & Tarr, D. Do. (2014). Anorganická chémia (5. vydanie.). New York: Pearson.
- Mishra, b., & Majumdar, G. (2017). Výroba alkalických kovov (Li, Na, K). Referenčný modul v materiálových vede a materiálových inžinierstve. Elsevier.
- Petrucci, r. H., Sleď, f. G., Bissonnette, c., & Zrelý, J. D. (2017). Všeobecná chémia: princípy a moderné aplikácie (11. vydanie.). New York: Pearson.
- Shriver, D., Weller, m., Overton, T., Rourke, J., & Armstrong, f. (2014). Anorganická chémia (6. vydanie.). New York: W. H. Freeman.
- « V ktorom kontinente je väčšia koncentrácia populácie?
- Charakteristiky veku bronzovej, obdobia, nástroje a vynálezy »

