Kovy
- 1238
- 14
- Denis Škriniar
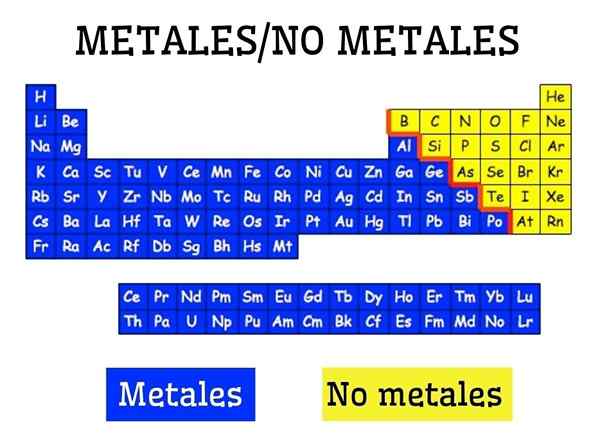
 Kovy a ne -metal v periodickej tabuľke prvkov
Kovy a ne -metal v periodickej tabuľke prvkov Čo sú kovy?
Kovy sú tvorené skupinou prvkov, ktoré sa nachádzajú na ľavej strane, s výnimkou nemetálneho vodíka, periodickej tabuľky. Kovy tvoria asi 75 % chemických prvkov, takže je možné uviesť, že veľká časť prírody je kovová.
Kovy, ktoré človek pôvodne stíhal v praveku. Dôvodom bolo skutočnosť, že boli pôvodní alebo ľahké spracovanie vykonávať úžitkové objekty.
Zdá sa, že mágiou je, že veľa hornín a minerálov je možné extrahovať lesklé a strieborné telá (až na určité dôležité a vynikajúce výnimky). Taký je prípad bauxitu a hliníka, ktorého hlinené skaly sa tento kov znížil v doštičkách alebo strieborných papieroch.
Kovy sú rámec priemyselných odvetví; Ich zapojenie, reaktory, jednotky, nádoby, všetky nejakým spôsobom sú zložené z kovov a ich zliatiny.
S kovmi boli vyrobené prvé mince, zbrane, náradie, brnenie a potom sa používali vo výrobkoch vozidiel, bicykloch, lodiach, lietadlách, počítačoch, okrem iných nevyhnutných predmetov v modernom živote.
História
Medený vek
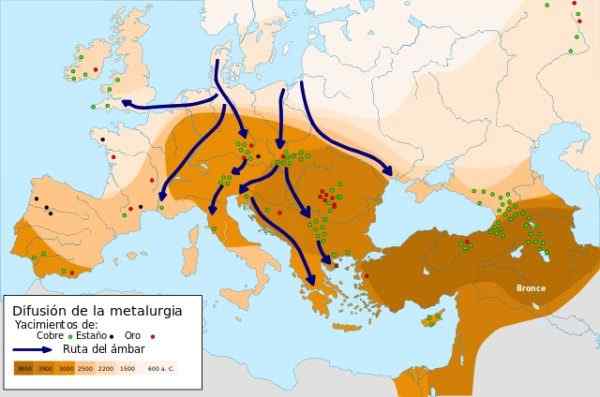 Rozšírenie metalurgie - Zdroj: Metalurgická difúzia.SVG pod licenciou Creative Commons Attribution-CompartyRigual 4.0 medzinárodný
Rozšírenie metalurgie - Zdroj: Metalurgická difúzia.SVG pod licenciou Creative Commons Attribution-CompartyRigual 4.0 medzinárodný V 9000 a.C. Prvé kovové predmety medi kované na Blízkom východe boli vypracované, keď muž zistil, že keď meď kladivá, zvýšil svoju silu a odpor, pričom ju použil na výrobu nožov. Toto je vek medi.
Zistilo sa, že meď sa dá získať zahrievaním modrých minerálov, ako je Corvellita a Malachit (4000-3000 až.C.).
Kalkolitické obdobie je obdobie, ktoré predchádza bronzovej dobe, zodpovedajúce 5000-3000.C. Muž začal experimentovať s fúziou a zlievárňou medi, aby sa získal meď kovaný z oxidu meďnatého.
Bronzová doba (3000-1500 a.C.)
 Materiály s bronzovým vekom - Zdroj: Gaguilella pod atribútom Creative Commons - Shareigual 4 Licencia 4.0 medzinárodný.
Materiály s bronzovým vekom - Zdroj: Gaguilella pod atribútom Creative Commons - Shareigual 4 Licencia 4.0 medzinárodný. Muž náhodou začal rozpracovanie zliatin, spočiatku medi a arzénu a potom s meďou a cínu, aby získal bronz na Blízkom východe.
Bronzové články, ktoré zodpovedajú tejto dobe, mali 87 % meď, 11 % cín a malé množstvo železa, arzénu, niklu, olova a antimónu.
Doba železa (700 a.C.)
Muž využil svoje skúsenosti s výrobou kovanej meďou na výrobu kovaných železa na Blízkom východe. V tom istom časovom období došlo k granulácii Etrusco Dust v Taliansku.
Prvá známa výroba ocele, zliatina železa a uhlíka, sa prejavila v kovových kusoch na archeologickom mieste v Anatólii (1800 až.C.)
Môže vám slúžiť: gravimetria: gravimetrická analýza, metódy, použitia a príkladySmerom k 1122 d.C., Na neznáme dátum a miesto sa zavádza liatina. V 1440 d.C. Vyrába sa Peking's Great Bell, Čína. Takmer o tri storočia neskôr, v roku 1709 D.C., liatina sa vyrába pomocou koksu ako horľavého materiálu.
V roku 1779 sa liatina v Anglicku použila ako architektonický materiál. V roku 1855 Henry Bessenir použil Arrabio ako surovinu na získanie mäkkej ocele. Anglický Clark a Wood (1872) patent zliatiny, ktorá sa v súčasnosti považuje za nehrdzavejúcu oceľ.
Fyzické vlastnosti kovov
 Bronz týchto starodávnych zvonov demonštruje užitočnosť kovov na okrasné alebo náboženské účely. Zdroj: pxhere.
Bronz týchto starodávnych zvonov demonštruje užitočnosť kovov na okrasné alebo náboženské účely. Zdroj: pxhere. Medzi niektoré fyzikálne vlastnosti kovov máme:
-Kovy sú vynikajúce a sú schopné odrážať svetlo.
-Všeobecne sú to dobré vodiče elektriny a tepla.
-Majú vysoké body fúzie a varu.
-Sú poddajné, to znamená, že môžu byť zatĺknu.

-Sú ťažní, s nimi môžete vyrábať drôty alebo vlákna s veľmi malým priemerom.
-Sú prezentované v pevnom stave, s výnimkou ortuti, že pri izbovej teplote je v kvapalnom stave a gália, ktoré sa topí len utiahnutím v rukách v rukách. Na nasledujúcom obrázku môžete vidieť kontajner ortuti:

-Sú to nepriehľadné telá, ich tenké plachty nie sú prekročené svetlom.
-Majú veľkú tvrdosť, s výnimkou sodíka a draslíka, ktoré je možné rozrezať nožom.
-Majú vysokú hustotu, sú osmium a iridium najvyššieho a lítium najnižšej hustoty.
Chemické vlastnosti kovov
Medzi niektoré chemické vlastnosti kovov máme:
-Majú tendenciu strácať elektróny a tvoria kovové katióny, mn+, kde n označuje jeho oxidačné číslo, ktoré sa iba pre alkalické a alkalistické kovy zhoduje s jeho valenčným číslom.
-Jeho elektronegativita je nízka.
-Bežajú a zažívajú oxidáciu poškodenia.
-Pri reagovaní s kyslíkom tvoria základné oxidy. Tieto oxidy v kombinácii s vodou tvoria kovové hydroxidy. Oxidy kovov reagujú s kyselinami za vzniku solí a vody.
-Sú to dobré redukčné činidlá, pretože poskytujú svoje elektróny.
Typy kovov
Kovy sa klasifikujú ako nasledujúce: alkalické, alkalické, post-transfitálne, prechodné a takzvané vzácne Zem.
Alkalické kovy

Zvyčajne sa ocitnú v prírode slobodní, pretože sa ľahko oxidujú. Mať suborbitálnu s1 Vo svojej vonkajšej orbitálnej vrstve, takže majú oxidačný stav +1. Sú to kovy, ktoré reagujú exotermicky s vodou a silne sa znižujú.
Alkalické telreos kovy
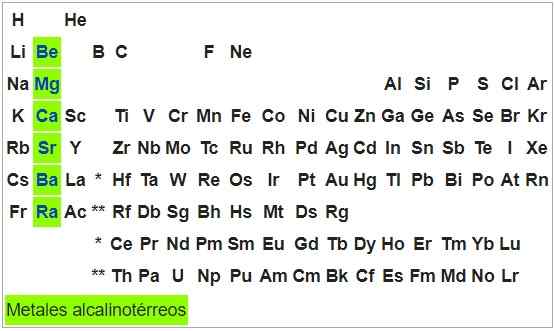
Sú kladivé a ťažné kovy. Atómy prvkov tejto skupiny majú konfiguráciu S2, Môžu teda poskytnúť dva elektróny a ich oxidačný stav je +2. S výnimkou berylia sú oxiditeľné na vystavenie vzduchu.
Môže vám slúžiť: uhlíkové alotropyPosttranné kovy
Sú to kovy takzvaného bloku P, ktorý sa nachádza medzi prechodnými kovmi a metaloidmi v periodickej tabuľke.
Prvky skupiny 3 majú oxidačné stavy +1 a +3 ako najbežnejšie, hoci hliník predstavuje iba oxidačný stav +3. Je tiež súčasťou post -pretransačných kovov nachádzajúcich sa v skupinách 14 a 15.
Prechodné kovy D
Tvoria skupinu medzi prvkami tvoriacimi základňami a kyslými formátormi. Atómové orbitály d a f sú neúplné a sú vyplnené. Aj keď sa termínové prechodné kovy vzťahujú na prechodné kovy d.
Prechodné kovy majú viac ako jeden oxidačný stav. Majú body fúzie a varu vyššie ako iné kovové skupiny. Prechodné kovy sú veľmi heterogénna kovová skupina, ktorá zahŕňa okrem iného železo, chróm, striebro atď.
Vzácna zem
 Minerál
Minerál Táto skupina kovov sa skladá z prvkov Scandio a Ititrio a prvky série latanidov a aktinidov. Termín „vzácna zem“ sa vzťahuje na skutočnosť, že sa nenachádzajú v povahe v čistých stavoch a sú pripojené kyselinami.
Použitie/aplikácie kovov
Alkalické kovy
Lítium sa používa ako prostriedok prenosu tepla v niektorých jadrových reaktoroch. Používa sa v niektorých suchých batériách a akumulátoroch malej hmotnosti. Chlorid a bromid lítium sú hygroskopické zlúčeniny, ktoré sa používajú v procesoch priemyselného sušenia a klimatizácie.
Sodík sa používa v metalurgii kovu, ako je titán a zirkónia. Používa sa pri verejnom osvetlení v oblúkových žiarovkách sodíka. Chlorid sodný (NaCl) sa používa ako potravinová príchuť a zachovanie mäsa.
Alkalineter
Horčík sa vo fotografii použil ako bleskové svetlo a ohňostroj. Bária je súčasťou zliatin používaných v zapaľovacích sviečkách kvôli ľahkému prvku na vyžarovanie elektrónov. Soli bária sa používajú na obmedzenie poškodenia spôsobeného X -Rays v doštičkách gastrointestinálnych traktov.
Vápnik sa používa na odstránenie nečistôt rozpustených v roztavených kovoch a pri odstraňovaní zvyškových plynov vo vákuových trubiach. Je súčasťou omietky, materiálu používaného pri konštrukcii a na spracovanie zlomenín kostí.
Posttranné kovy
Hliník, pretože je to ľahký kov, sa používa pri výstavbe lietadiel a plavidiel. Používa sa tiež na vypracovanie mnohých kuchynských náter. Používa sa ako surovina pri výrobe dezodorantov, ktoré obmedzujú potenie.
Môže vám slúžiť: Percentuálne riešeniaGallium sa používa v tranzistoroch a teplomeroch na vysoké teploty. Izotop 67GA sa používa v medicíne pri liečbe niektorých melanómov. Olovo sa používa pri výstavbe batérií av ochrane pred ionizujúcim žiarením.
Prechodné kovy
Meď sa používa v vodných potrubiach, v chladničkách a klimatizačných systémoch. Používa sa tiež ako súčasť mechanizmu rozptyľovania tepla. Používa sa na vedenie elektrického prúdu, v elektromagnetoch a pri sfarbení skla.
Jazda sa používa pri vypracovaní nehrdzavejúcej ocele, ako aj na gitarových reťazcoch a nabíjateľných batériách. Používa sa tiež v galvanoplastike pri ochrane kovov. Používa sa v zliatinách nachádzajúcich sa v častiach vozidiel, ako sú ventily, ložiská a brzdy.
Nikel sa používal po dlhú dobu pri vypracovaní mincí.
Zinok sa používa pri ochrane proti korózii kovov, pri výrobe mosadze. Na výrobu dosiek používaných v streche, žľaboch a downpouts sa používajú oxid zinočnatý a síran zinok.
Chróm sa používa v ochrane kovovej korózie a dodávka dodávok lesk. Používa sa ako katalyzátor v reakcii na syntézu amoniaku (NH3). Oxid chrómu sa používa na ochranu dreva.
Vzácna zem
Scandio sa používa v hliníkovom hliníku pre letecké komponenty. Je to prísada v ortuťových parných žiarovkách.
Lantano sa používa vo vysokom refrakcii a vo výške alkalis. Okrem toho sa používa na výrobu šošoviek kamier a ako katalytické katalyzátorové tekutiny pre ropné rafinérie.
CERIO sa používa ako chemické činidlo. Okrem toho sa používa na dodávku žltého skla a keramického sfarbenia, ako aj katalyzátor pre samonosné pece.
Príklady kovových prvkov
Alkalický
Sodík (NA), draslík (k), cesio (CS), lítium (Li) a rubidium (RU).
Zásady
Berylium (BE), horčík (mg), vápnik (CA), strontium (MR), bária (BA) a rádio (RA).
Posttransficiálny
Hliník (al), gallium (GA), Indian (in), Talio (TL), Tin (SN) a olovo (PB).
Prechodný
Titán (Ti), vanadium (V), chróm (CR), mangán (MN), železo (viera), kobalt (CO), Nickel (Ni), meď (CUINC), zinok (Zn), zircónia (ZR), Niobio (NB), Molybdenum (MO), Paladio (PD), Silver (AG), Volframium (W), Renio (RE), Osmio (OS), Iridido (IR),
Platinum (PT), zlato (Au) a ortuť (HG).
Vzácna zem
Scandio (SC), Itrio (Y), Lantano (LA), Cerio (CE), Praseodimio (PR), Neodymium (ND), Samarium (SM), Europio (EU), Gadolinio (GD), Holmio (HO), Erbio (ER), Tulio (TM), Iterbio (YB) a Luthacio (Lu).
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- HelMestine, Anne Marie, PH.D. (5. októbra 2019). Kovy verzus neovládky. Zotavené z: Thoughtco.com
- Kovy a ich vlastnosti-fyzické a chemické. [PDF]. Získané z: CSUN.Edu
- Majster Jonathan. (2019). 18 rôznych typov kovu (fakty a použitia). Obnovené z: MakeItfrommetal.com

