Leucínové charakteristiky, štruktúra, funkcie, biosyntéza
- 2386
- 579
- Ing. Ervín Petruška
Ten Leucín Je to jeden z 22 aminokyselín, ktorý tvorí proteíny živých organizmov. To patrí do jednej z 9 esenciálnych aminokyselín, ktoré nie sú syntetizované telom a musia sa konzumovať s potravinami požitým v diéte.
Leucina bol prvýkrát opísaný v roku 1818 francúzskym lekárnikom a chemikom. L. Proust, ktorý to nazval „oxidom“. Neskôr ho Erlenmeyer a Kunlin pripravili z kyseliny a-benzoilamido-p-izopropilakrylovej, ktorej molekulárny vzorec je C6H13NO2NO2.
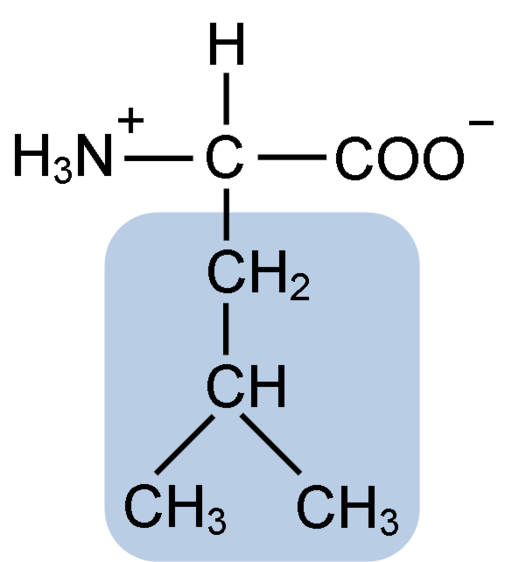
 Chemická štruktúra leucínovej aminokyseliny (Fuene: Clavecin [CC By-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Via Wikimedia Commons)
Chemická štruktúra leucínovej aminokyseliny (Fuene: Clavecin [CC By-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Via Wikimedia Commons) Leucín bol kľúčový počas objavu pocitu translácie proteínu, pretože jeho hydrofóbna štruktúra umožnila biochemizmu Howardovi Dentzisovi rádioaktívne označiť vodík uhlíka 3 a pozorovať význam, v ktorom sú aminokyseliny začlenené do peptidovej syntézy hemoglobínu.
Proteíny známe ako „zips“ alebo „uzávery“ leuciny sú spolu s „zinkovými prstami“ najdôležitejšími transkripčnými faktormi eukaryotických organizmov. Leucine zipsy sa vyznačujú svojimi hydrofóbnymi interakciami s DNA.
Všeobecne platí, že proteíny bohaté na leucín alebo tvorené rozvetvenými aminokyselinami sa v pečeni metabolizujú, namiesto toho idú priamo do svalov, kde sa rýchlo používajú na syntézu proteínov a získanie energie.
Leucín je aminokyselina rozvetveného reťazca potrebná na biosyntézu proteínov a aminokyselín mlieka, ktoré sú syntetizované v prsníkových žľazách. Vo vnútri materského mlieka nájdete veľké množstvo tejto voľnej aminokyseliny.
Medzi všetkými aminokyselinami, ktoré tvoria proteíny, sú leucín a arginín najhojnejší a obe boli detegované v proteínoch všetkých kráľovstiev, ktoré tvoria strom života.
[TOC]
Charakteristika
Leucín je známy ako esenciálna aminokyselina rozvetveného reťazca, zdieľa typickú štruktúru s ostatnými aminokyselinami. Rozlišuje sa však, pretože jeho bočný reťazec alebo skupina R má spojené dva uhlíky a posledný je spojený s atómom vodíka a dvoma metylovými skupinami.
Patrí do skupiny polárnych aminokyselín bez zaťaženia, substituenty alebo skupiny týchto aminokyselín sú hydrofóbna a nepolárna povaha. Tieto aminokyseliny sú hlavným zodpovedným za intra-protetické hydrofóbne interakcie a majú tendenciu stabilizovať štruktúru proteínov.
Všetky aminokyseliny, ktoré majú centrálny uhlík, ktorý je chirálny (uhlík a), to znamená, že má štyri rôzne United Substituents, možno ich nájsť dvoma rôznymi spôsobmi; Existujú teda D- a L-Leucina, ktoré sú typické v proteínových štruktúrach.
Obe formy každej aminokyseliny majú rôzne vlastnosti, zúčastňujú sa na rôznych metabolických trasách a môžu dokonca modifikovať charakteristiky štruktúr, ktorých sú súčasťou.
Napríklad leucín v L-Leucine má mierne horkú chuť, zatiaľ čo vo svojej forme D-Leucin je veľmi sladký.
Forma akejkoľvek aminokyseliny sa ľahšie metabolizuje telom cicavcov. L-Leucina sa ľahko degraduje a využíva na výstavbu a ochranu proteínov.
Štruktúra
Leucine pozostáva zo 6 atómov uhlíka. Centrálny uhlík, bežný vo všetkých aminokyselinách, je spojený s karboxylovou skupinou (COOH), aminoskupinou (NH2), atómom vodíka (H) a bočným reťazcom alebo skupinou R R zloženou zo 4 atómov uhlíka.
Môže vám slúžiť: MesothelioAtómy uhlíka v aminokyselinách môžu byť identifikované gréckymi písmenami. Číslovanie sa začína z uhlíka karboxylovej (COOH), zatiaľ čo anotácia s gréckou abecedou začína z centrálneho uhlíka.
Leucín má ako substituentnú skupinu vo svojom reťazci R pre skupinu izobutylovej alebo 2-metylpropilovej skupiny, ktorá je produkovaná stratou atómu vodíka, s tvorbou alkylového radikálu; Tieto skupiny sa javia ako dôsledky v štruktúre aminokyselín.
Funkcia
Leucín je aminokyselina, ktorá môže slúžiť ako ketogénny prekurzor iných zlúčenín zapojených do cyklu kyseliny citrónovej. Táto aminokyselina predstavuje dôležitý zdroj pre syntézu acetyl-CoA alebo acetoacetyl-CoA, ktoré sú súčasťou tvorcových trás ketónových telies v pečeňových bunkách.
Je známe, že leucín je nevyhnutný na inzulínových signálnych trasách, ktoré sa podieľajú na začiatku syntézy proteínov a vyhýba sa strate proteínu v dôsledku degradácie.
Vnútorné štruktúry proteínov sú zvyčajne zložené z hydrofóbnych aminokyselín, ako je leucín, valín, izoleucín a metóda. Takéto štruktúry sú zvyčajne konzervované pre bežné enzýmy medzi živými organizmami, ako v prípade cytochrómu C.
Leucín môže aktivovať metabolické trasy v bunkách prsných žliaz na stimuláciu syntézy laktózy, lipidov a proteínov, ktoré plnia funkcie, ako sú signálne molekuly pri regulácii energetickej homeostázy mladých u cicavcov.
Domény bohaté na leucín sú nevyhnutnou súčasťou špecifických proteínov väzbových DNA, ktoré sú všeobecne štrukturálnymi priemermi super zaradeným spôsobom a ktoré sú známe ako „leucínové proteíny zipsu“.
Tieto proteíny majú ako výraznú charakteristiku pravidelný vzorec opakovaných leucínov spolu s inými hydrofóbnymi aminokyselinami, ktoré sú zodpovedné za reguláciu odborov transkripčných faktorov do DNA a medzi rôznymi transkripčnými faktormi.
Leucin PSIP proteíny môžu tvoriť homo alebo heterodiméry, ktoré im umožňujú.
Biosyntéza
Všetky aminokyseliny rozvetveného reťazca, vrátane leucínu, sa syntetizujú hlavne v rastlinách a baktériách. V kvitnúcich rastlinách dochádza k významnému nárastu produkcie leucínu, pretože je dôležitým predchodcom všetkých zlúčenín zodpovedných za arómu kvetov a ovocia.
Jedným z faktorov pripisovaných veľkému množstvu leucínu v rôznych bakteriálnych peptidoch je to, že 6 rôznych kodónov genetického kódu kódovania leucínu (UUA-UUG-UUCU-CUC-CUA-KUG), to isté platí aj pre arginine.
Leucín je syntetizovaný v baktériách z piatich -step trasy, ktorá sa používa ako východiskový bod ketacid súvisiaci s valínom.
Tento proces je regulovaný aostericky, takže keď existuje nadbytok leucínu vo vnútri bunky, inhibuje enzýmy, ktoré sa zúčastňujú na trase a zastaví syntézu.
Môže vám slúžiť: Simpson Index: vzorec, interpretácia a príkladBiosintetická cesta
Biosyntéza leucínu v baktériách sa začína konverziou derivátovej ketacidy valínu, 3-metyl-2-oxobutánu v (2S) -2-izopropilmaláte, a to vďaka pôsobeniu enzýmu 2-izopropilmalto synta, ktoré používajú acetyl. -Coa a voda na tento účel.
(2S) -2-izopropilmalaát stráca molekulu vody a transformuje sa na 2-izopropilmaleate 3-izopropylmalátovou dehydratázou. Následne ten istý enzým pridáva ďalšiu molekulu vody a transformuje 2-izopropilmaleato do (2R-3S) -3-izopropilmu.
Táto zlúčenina je podrobená oxidorredukčnej reakcii, ktorá si zaslúži účasť molekuly NAD+, ktorá produkuje (2S) -2-izopropil-3-oxosukcináciu, ktorá je možná účasťou enzýmu 3-izopropilmato delbrogén.
(2S) -2-obopropyl-3-oxosukcinácia stráca atóm uhlíka vo forme spontánne CO2 a vytvára 4-metyl-2-oxopentanoát, ktorý špecificky pôsobím transaminázou rozvetveného reťazca (transaminázový leucín) A so sprievodným oslobodením L-glutamátu a 2-oxoglutarátu produkuje L-Leucinu.
Degradácia
Hlavnou úlohou leucínu je pôsobiť ako signalizácia, ktorá hovorí bunke, že na začatie syntézy svalových proteínov existuje dostatok aminokyselín a energie.
Degradácia aminokyselín rozvetveného reťazca, keď leucín začína transamináciou. Tento a dva následné enzymatické kroky sú katalyzované tromi enzýmami v prípade leucínu, izoleucínu a valínu.
Transaminácia troch aminokyselín produkuje tieto a-ekotoacidické deriváty, ktoré sú vystavené oxidačnej dekarboxylácii na výrobu acyl-CoA tioéov, ktoré sú a, β-dishydrogenerácie na vykonávanie tioéov de acil-coA a, p-izomraovaných.
Počas leucínového katabolizmu sa zodpovedajúci acyl-CoA odhaľuje p-insatura p-insatura (HMG-CoA), ktorá je sprostredkovateľom v biosyntéze cholesterolu a iných izoprenoidov.
Katabolická cesta leuciny
Z tvorby acyl-CoA strýka a, p-insastovaného, ktorý vyplýva z leucínu, katabolické cesty tejto aminokyseliny a valínu a izoleucín sa značne líšia.
Acyl-CoA uciona a, β-insastovaná leucina sa spracováva po prúde tromi rôznymi enzýmami známymi ako (1) 3-metylcrotyl-CoA karboxyláza, (2) 3-metylglutatataconil-coA hydratasa a (3) 3-hydroxi-3-metylgluiliLiLiLILILILILIL -Coa liasa.
V baktériách sú tieto enzýmy zodpovedné za konverziu 3-metylkrotyl-coA (leucín derivát) v 3-metylglutaconil-coA, v 3-hydroxy-3-metylglutarilových-CoA a v acetoacetáte a acetyl-coA, respektíve.
Leucín, ktorý je k dispozícii v krvi, sa využíva na syntézu svalových/myofibrilárnych proteínov (MPS). Toto pôsobí ako aktivačný faktor tohto procesu. Tiež interagovať priamo s inzulínom, čo ovplyvňuje dodávku
Jedlá bohaté na leucine
Konzumácia bohatých aminokyselinových proteínov je nevyhnutná pre bunkovú fyziológiu živých organizmov a leucín nie je výnimkou medzi esenciálnymi aminokyselinami.
Proteíny získané z mliečneho séra sa považujú za najbohatšie zvyšky L-Leucina. Všetky potraviny s vysokým obsahom bielkovín, ako sú ryby, kurča, vajcia a červené mäso.
Môže vám slúžiť: Reprodukcia vírusov: fázy a vlastnostiKukurica v zrne je zlá v aminokyselinách lyzínu a tryptofánu, má veľmi tuhé terciárne štruktúry pre trávenie a má malú hodnotu z výživového hľadiska, má však vysokú hladinu leucínu a izoleucín.
Plody rastlín strukoviny sú bohaté na takmer všetky esenciálne aminokyseliny: lyzín, treonín, izoleucín, leucín, fenylalanín a valín, ale majú malý obsah v metóde a cysteín.
Leucín sa extrahuje, čistí a koncentruje sa v tabletoch ako potravinové doplnky pre športovcov s vysokou konkurenciou a uvádza na trh ako liek. Hlavný zdroj izolácie tejto aminokyseliny zodpovedá sójovej sójovej múke.
Existuje výživový doplnok, ktorý používajú športovci na regeneráciu svalov známe ako BCAA (angličtina “Aminokyselina rozvetveného reťazca “). Toto poskytuje vysoké koncentrácie aminokyselín rozvetveného reťazca: leucina, valina a izoleucín.
Výhody vášho príjmu
Potraviny bohaté na leucine pomáhajú kontrolovať obezitu a iné metabolické choroby. Mnoho odborníkov na výživu poukazuje na to, že potraviny bohaté na leucín a výživové doplnky na základe tejto aminokyseliny prispievajú k regulácii chuti do jedla a úzkosti u dospelých.
Všetky proteíny RRICK stimulujú syntézu svalových proteínov; Ukázalo sa, že zvýšenie podielu požívaného leucínu vzhľadom na ďalšie esenciálne aminokyseliny môže zvrátiť útlm syntézy proteínov v svalovej svale starších pacientov.
Dokonca aj ľudia s vážnymi makulárnymi poruchami, ktoré sú paralyzované.
Leucín, valín a izoleucín sú základnými zložkami hmoty, ktorá tvorí kostrové svaly zvierat stavovcov, takže ich prítomnosť je nevyhnutná pre syntézu nových proteínov alebo pre opravu predbežného existujúcich.
Poruchy nedostatku
Nedostatky alebo malformácie komplexu a-Zo-utlačitého dehydrogenázy, ktorý je zodpovedný za metabolizáciu leucínu, valínu a izoleucínu u ľudí, môžu spôsobiť vážne duševné poruchy.
Okrem toho existuje patologický stav súvisiaci s metabolizmom týchto aminokyselín rozvetveného reťazca nazývaný „choroba moču s vôňou sirupu arce“.
K dnešnému dňu nebola preukázaná existencia nepriaznivých účinkov na nadmernú spotrebu leucínu. Odporúva sa však maximálna dávka 550 mg/kg.
Odkazy
- Álava, m. D. C., Camacho, m. A., & Delgadillo, J. (2012). Zdravie svalov a prevencia sarkopénie: účinok proteínu, leucínu a ß-hydroxy-ß-metylbutirát. Časopis o metabolizme kostí a minerálov, 10(2), 98-102.
- Phenheme, alebo. R. (1993). Chémia potravín (Nie. 664: 543). Príťažlivosť.
- Massey, L. Klimatizovať., Sokatch, J. R., & Conrad, R. Siež. (1976). Aminokyselinový katabolizmus rozvetveného reťazca v baktériách. Bakteriologické recenzie, 40(1), 42.
- Mathews, C. Klimatizovať., & Ahern, K. G. (2002). Biochémia. Pearson Vzdelanie.
- Iba, a. (1999). Doplnenie leucínu a intenzívny výcvik. Športový liek, 27(6), 347-358.
- Munro, h. N. (Ed.). (2012). Metabolizmus proteínov cicavcov (Zv. 4). Elsevier
- Nelson, D. L., Lehninger, a. L., & Cox, M. M. (2008). Lehninger princípy biochémie. Macmillan.

