Koncepcia adsorpčných izotermov, typy, príklady
- 4735
- 530
- Tomáš Klapka
Ten Izotermy adsorpcie Sú to grafické znázornenie správania adsorbovanej častice, na povrchu tuhej látky alebo kvapaliny, keď sa zvýši jej koncentrácia. Ak adsorbované častice zodpovedajú oblastiam plynu, zohľadní sa jeho tlak.
Pozorovaním tejto izotermy je možné uskutočniť myšlienku, ako dochádza k adsorpčnému procesu; A preto, ako sú interakcie častíc a povrchové charakteristiky. Analýza izotermy sa odvodzuje, ak je povrch hladký, pórovitý alebo mikroporézny, ako aj možné kondenzácie, ako aj možné kondenzácie.
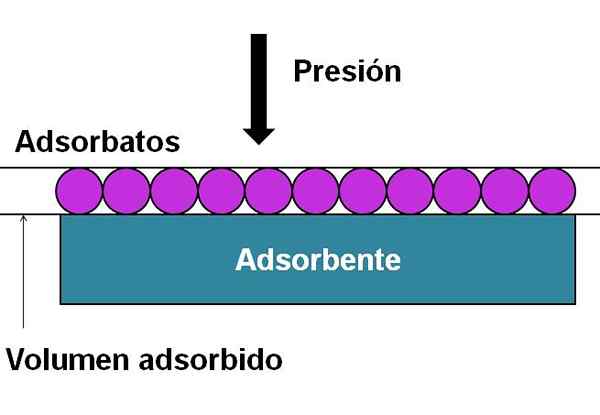
 Komponenty potrebné na graf alebo konštrukciu adsorpčných izotermov. Zdroj: Gabriel Bolívar.
Komponenty potrebné na graf alebo konštrukciu adsorpčných izotermov. Zdroj: Gabriel Bolívar. Vynikajúci obrázok pomáha objasniť vyššie uvedené. Adsorbované častice (fialové kruhy) sú tak -zavolané adsorbáty. Zatiaľ čo adsorbent je tá, ktorá má oblasť, na ktorej budú adsorbáty adsorbované. Ako sa zvyšuje váš tlak alebo koncentrácia, čím väčší je adsorbovaný objem pred adsorbentom.
Táto jednoduchá reprezentácia zodpovedá adsorpcii opísanej izotermou typu I. Použitie izotermy, študujú sa adsorpcie plynov alebo kvapalných nekonečností na géloch, tuhých látkach alebo katalyzátoroch.
[TOC]
Typy adsorpčných izotermov
 Adsorpčné izotermy pre plynové systémy. Zdroj: Daniele Pugliesi/CC By-S (https: // creativeCommons.Org/licencie/By-SA/3.0)
Adsorpčné izotermy pre plynové systémy. Zdroj: Daniele Pugliesi/CC By-S (https: // creativeCommons.Org/licencie/By-SA/3.0) Päť z hlavných experimentálnych izotermy používaných S je uvedené vyššie. Brunauer na klasifikáciu plynných častíc na pevných látkach. Každý opisuje iný adsorpčný proces. Každý z nich má tiež matematické modely, ktoré sa snažia odvodiť správanie svojich kriviek.
Nerozmerné, aké sú jednotky alebo premenné používané v osi x (p/PO) a y (x), os x naznačuje, aký veľký tlak alebo konverzia adsorbovaných „akcií“ na pevnú látku; Zatiaľ čo os y, hovorí, koľko z tohto adsorbátu bolo skutočne adsorbované na povrchu uvedenej tuhej alebo adsorbentovej.
Môže vám slúžiť: sulfát meďnatého (CUSO4): Štruktúra, vlastnosti, získanie, použitiaKeď sa teda pohybujeme doprava od osi X, vidíme, ako sa zvyšuje množstvo adsorbovaných častíc v závislosti od zvýšenia ich tlakov alebo koncentrácií. To vedie k maximálnemu rozkladu, údolia atď., ktoré nejako alebo iným umožňuje interpretovať, ako dochádza k adsorpcii.
Izoterma typu I
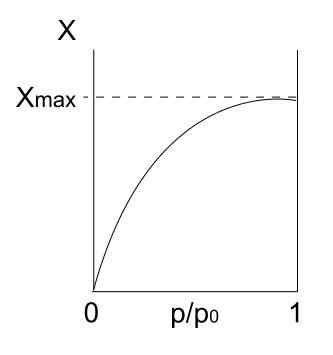 Izoterma typu I. Zdroj: Daniele Pugliesi/CC By-S (https: // creativeCommons.Org/licencie/By-SA/3.0)
Izoterma typu I. Zdroj: Daniele Pugliesi/CC By-S (https: // creativeCommons.Org/licencie/By-SA/3.0) Máme vyššie uvedenú izotermu typu I, ktorá je známa aj ako Langmuir Isotherm, pretože jej model predpovedal tvar tejto krivky. Vidíte to, okamžite sa interpretuje, že existuje maximálne množstvo (xmax) adsorbovaných častíc, ktoré sa nebudú meniť bez ohľadu na to, do akej miery sa tlaky zvyšujú.
Táto maximálna adsorpčná hodnota môže byť z niekoľkých dôvodov. Jedným z nich je, že sa deje chemisorkcia, čo znamená, že častice alebo adsorbáty sú silne viazané na povrch tuhej látky alebo adsorbentu. Akonáhle už nie je na povrchu viac miesta na umiestnenie ďalších častíc, už nebude adsorpcia.
Potom sa hovorí, že sa vytvorila monovrstva (napríklad fialové kruhy prvého obrázka).
Ďalším dôvodom na odôvodnenie izotermy typu I je to, že dochádza k fisisorpcii, čo znamená, že interakcie častíc na povrchu sú veľmi slabé (neznamená tvorbu chemických väzieb).
V tomto prípade častice nakoniec vstupujú do Microporos, ktoré po naplnení, povrch nebude mať viac miest pre nasledujúce adsorcie; To znamená, že má k dispozícii málo externej oblasti (akoby to bola veľmi jemná mriežka). Toto správanie sa pozoruje pri analýze mikroporéznych práškov.
Môže vám slúžiť: kremík: História, vlastnosti, štruktúra, získanie, použitieIzoterma typu Ii
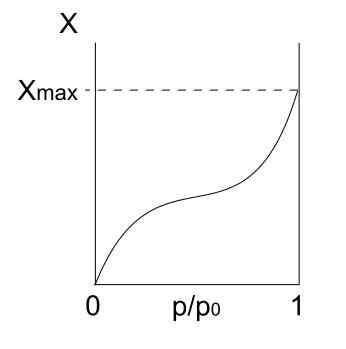 Izoterma typu II. Zdroj: Daniele Pugliesi/CC By-S (https: // creativeCommons.Org/licencie/By-SA/3.0)
Izoterma typu II. Zdroj: Daniele Pugliesi/CC By-S (https: // creativeCommons.Org/licencie/By-SA/3.0) Up máme izotermu typu II, známu tiež ako sigmoidná izoterma. Toto popisuje fyzické procesy pre nepodporné tuhé látky a makroporézne tuhé látky.
Všimnite si, že na začiatku pripomína predchádzajúcu izotermu, čo znamená, že adsorbované častice tvoria monovrstvu na povrchu adsorbentu. Akonáhle je monovrstvá pripravená, ďalšie častice budú adsorbované na vrchole bývalých, čím sa objaví viacvrstvové. To je, keď vidíme charakteristické zvýšenie tejto izotermy (vpravo).
Ďalším dôvodom, prečo sa získa izoterma typu II, je to, že častice cítia väčšiu afinitu k povrchu ako oni. To znamená, že monovrstvá (častíc superficie) bude stabilnejšia a trvalejšia ako viacvrstvové (častice častíc) neskôr.
Izoterma typu Iii
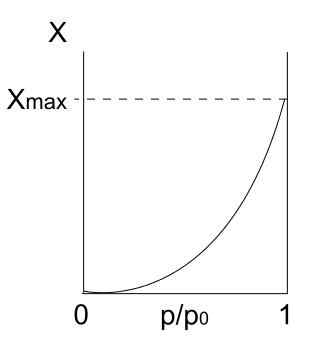 Izoterma typu III. Zdroj: Daniele Pugliesi/CC By-S (https: // creativeCommons.Org/licencie/By-SA/3.0)
Izoterma typu III. Zdroj: Daniele Pugliesi/CC By-S (https: // creativeCommons.Org/licencie/By-SA/3.0) Izoterma typu III je podobná ako typ II, pokiaľ ide o jeho interpretáciu: multicapas a Physis. Tentoraz sú však interakcie medzi multicapas silnejšie ako interakcie monovrstvy s povrchom tuhej látky. Preto ide o nepravidelnú adsorpciu, s kopcami adsorbovaných častíc a voľných častí povrchu.
Izoterma typu Iv
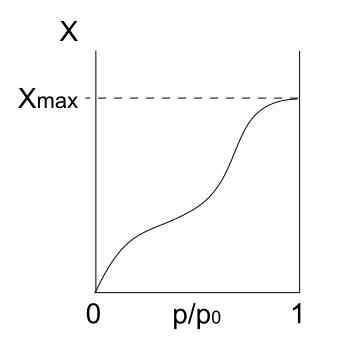 IV IV IV. Zdroj: Daniele Pugliesi/CC By-S (https: // creativeCommons.Org/licencie/By-SA/3.0)
IV IV IV. Zdroj: Daniele Pugliesi/CC By-S (https: // creativeCommons.Org/licencie/By-SA/3.0) Typ IV Isotherm tiež popisuje fisisorpčné a viacvrstvové procesy, ktoré vyzerajú ako izoterma typu II; Ale teraz v poréznych (a mezoporéznych) tuhých látkach, kde je kondenzácia plynných častíc možná v malých objemoch kvapaliny. Kým nie je „zakrytý pór s tekutinou“, monovrstvá nebude dokončená.
Môže vám slúžiť: Potravinová chémia: Študijný odbory, prvky, aplikácieIzoterma typu Vložka
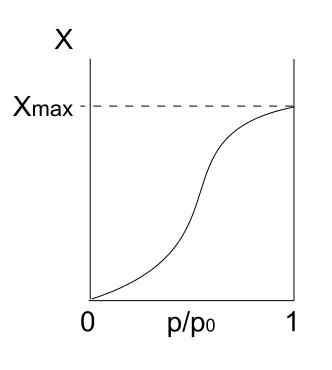 Izoterma typu V. Zdroj: Daniele Pugliesi/CC By-S (https: // creativeCommons.Org/licencie/By-SA/3.0)
Izoterma typu V. Zdroj: Daniele Pugliesi/CC By-S (https: // creativeCommons.Org/licencie/By-SA/3.0) Izoterma typu V je podobná ako typ IV, iba tentokrát sú formácie multicapas náchylnejšie ako príslušné mono forpa. To znamená, že sa podobá adsorpcii opísanej izotermou typu III. Tu Multicapa dosahuje maximálnu hrúbku, kde nie sú miesta pre viac častíc na adsorbovanie.
Príklady
Niektoré príklady plynových pevných systémov budú uvedené nižšie vedľa typu izotermov, ktoré boli získané v ich experimentálnych štúdiách:
-Amoniak-uhlík (typ I)
-Dusík-zeolity (typ I)
-Vodíkový uhlík pri vysokých teplotách (typ I)
-Uhoľný kyslík-Negro (typ I)
-Dusík z kremičitého (typ II)
-Dusík-hierro (typ II)
-Kremičitý bromo-gel (typ III)
-Pary jódový oxid kremičitý (typ III)
-Politický dusík (typ III)
-Kripton-Negro z uhlia (typ IV)
-Benzén-gel oxidu železitého (typ IV)
-Vodná pary-uhlík (typ V)
Všimnite si, že uvedené tuhé látky boli uhlie, čierne uhlie, kovové železo, oxid železa, zeolity a silikagél. Všetky sú dobrým príkladom adsorbov s rôznymi priemyselnými aplikáciami.
Odkazy
- Walter J. Moore. (1963). Fyzikálna chémia. V termodynamike a chemickej rovnováhe. (Štvrté vydanie.). Longmans.
- Irán. Levine. (2009). Princípy fyzikálneho spôsobu. Šieste vydanie, strana 479-540. MC Graw Hill.
- Glasstón. (1970). Učebnica fyzikálnej chémie. Druhé vydanie. D. Van Nostrand, spoločnosť, Inc.
- Jednotka 3. Povrchové javy. (s.F.). Adsorpcia. [PDF]. Získané z: Depa.Frame.Žobrák.mx
- Lowell S., Shields J.A. (1984) Adsorpčné izotermy. In: Prášková plocha a pórovitosť. Springer, Dordrecht.
- Elsevier B.Vložka. (2020). Izoterma adsorpcie. Vedecký. Zdroj: ScienceDirect.com
- Wikipedia. (2020). Adsorpcia. Zdroj: In.Wikipedia.orgán

