Izoleucín charakteristiky, funkcie, biosyntéza, jedlo
- 3826
- 896
- Mgr. Pravoslav Mokroš
Ten izoleucín (Ile, i) je jedným z 22 aminokyselín prítomných v prírode ako súčasť proteínov. Vzhľadom na skutočnosť, že ľudské telo, podobne ako u niektorých iných cicavcov, ho nemôže syntetizovať, izoleucín patrí medzi 9 esenciálnych aminokyselín, ktoré je potrebné získať s diétou.
Túto aminokyselinu bol prvýkrát izolovaný v roku 1903 vedcom f. Ehrlich z dusíkových zložiek melasy repy alebo repy. Následne ten istý autor oddelený izoleucín od produktov rozkladu fibrínu a iných proteínov.
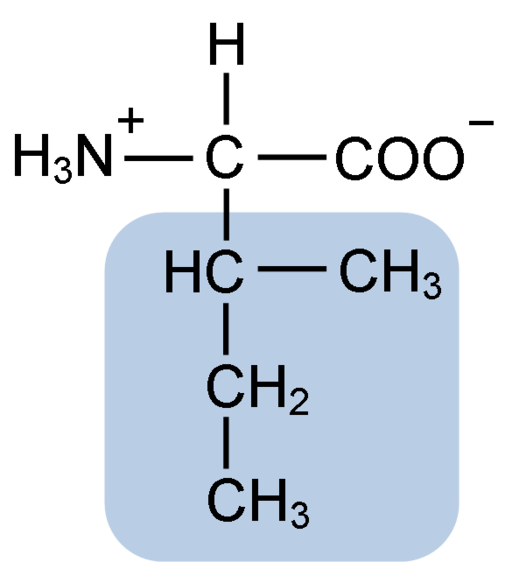
 Chemická štruktúra izoleucínovej aminokyseliny (zdroj: klavecín [CC By-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Via Wikimedia Commons)
Chemická štruktúra izoleucínovej aminokyseliny (zdroj: klavecín [CC By-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Via Wikimedia Commons) Je to nepolárna aminokyselina prítomná vo väčšine bunkových proteínov živých organizmov, navyše je súčasťou aminokyselín rozvetveného reťazca BCAAS (z angličtiny BRančovaný CHain DoMôj nie DoCID), Spolu s Leucinou a Valinou.
Má funkcie pri vytváraní terciárnej štruktúry mnohých proteínov a navyše sa podieľa na tvorbe rôznych metabolických prekurzorov súvisiacich s metabolizmom bunkovej energie.
[TOC]
Charakteristika
Izoleucín je klasifikovaný v skupine bez polárnych aminokyselín so skupinami alebo reťazami aifatickej povahy, to znamená s uhľovodíkovými uhľovodíkovými reťazcami.
Kvôli tejto charakteristike majú aminokyseliny tejto skupiny, ako je alanín, valina a leucina.
Táto nepolárna aminokyselina váži približne 131 g/mol a je prítomná v proteínoch v pomere blízko 6%, často „pochovaných“ v ich strede (vďaka jeho hydrofóbnym vlastnostiam).
Štruktúra
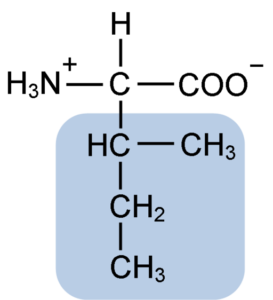
Izoleucín je a-aminokyselina, ktorá, rovnako ako ostatné aminokyseliny, má centrálny atóm uhlíka nazývaný a (ktorý je chirálny), ku ktorému sú spojené štyri rôzne skupiny: atóm vodíka, aminoskupina (-NH2), A karboxylová skupina (-COH) a bočný reťazec alebo r grupo.
Izoleucínová skupina R pozostáva z jednoduchého rozvetveného uhľovodíka 4 atómov uhlíka (-ch3-ch2-ch (CH3)), v ktorej reťazci je tiež atómový atóm uhlíka.
Kvôli tejto charakteristike má izoleucín štyri možné spôsoby: dva z nich sú optické izoméry známe ako L-izoleucín a D-izoleucín a ďalšie dva sú diastereoizoméry L-izoleucín. Prevažnou formou v proteínoch je l-izoleucín.
Molekulárny vzorec izoleucínu je C6H13NO2 a jeho chemický názov je a-amino-P-METYL-β-etylpropionický alebo 2-amino-3-metyl-metyl pentatonový kyselina alebo kyselina kyselina kyselina kyselina kyselina kyselina kyselina kyselina kyselina kyselina kyselina kyselina alebo kyselina kyselina kyselina kyselina kyselina kyselina kyselina kyselina alebo kyselina kyselina kyselina kyselina kyselina kyselina alebo kyselina kyselina kyselina kyselina kyselina kyselina alebo kyselina kyselina kyselina kyselina kyselina alebo kyselina kyselina kyselina.
Funkcia
Izoleucín má u zvierat viac fyziologických funkcií vrátane
- Hojenie rán
- Detoxikácia odpadu dusíka
- Stimulácia imunitných funkcií a
- Podpora sekrécie rôznych hormónov.
Považuje sa za glykogénnu aminokyselinu, pretože slúži ako prekurzorová molekula pre syntézu sprostredkovateľov cyklu citrusovej kyseliny (cyklus Krebs), ktorá následne prispieva k tvorbe glukózy v pečeni.
Z tohto dôvodu sa predpokladá, že izoleucín sa podieľa na regulácii hladín glukózy v plazme, čo má dôležité dôsledky z hľadiska energetiky tela.
Izoleucín prispieva k syntéznym trasám glutamínu a alanínu, ktoré pracujú v prospech rovnováhy medzi aminokyselinami rozvetveného reťazca.
V klinickom poli niektorí autori zdôrazňujú, že zvýšenie koncentrácií izoleucínu, leucínu, tyrozínu a valínu môže byť charakteristickými markermi buniek ovplyvnených nádorom, po ktorom nasleduje zvýšenie hladín glutamínu.
Iné funkcie
Rôzny vedecký výskum ukázal, že izoleucín je potrebný na syntézu hemoglobínu, proteínu, ktorý je zodpovedný za transport kyslíka v krvi mnohých zvierat.
Táto aminokyselina okrem toho aktivuje vstup živín do buniek; Niektoré štúdie ukazujú, že počas predĺženého pôstu je schopný nahradiť glukózu ako zdroj energie a navyše je to ketogénna aminokyselina.
Môže vám slúžiť: Časová os biológieKetogénne aminokyseliny sú tie, ktorých uhlíkové kostry sa môžu skladovať, ako sú mastné kyseliny alebo uhľohydráty, takže pracujú v energetickej rezervácii.
Izoleucín a iné rozvetvené aminokyseliny (okrem rastových faktorov a podmienok prostredia) pracujú na aktivácii bielej alebo cieľovej signalizačnej cesty rapamycínu, mTOR (z angličtiny mTananistický TónArget aniF RApamycín).
Táto trasa je dôležitou signalizačnou cestou v eukaryotoch schopných kontrolovať rast buniek a metabolizmus, ako aj proteínové syntéza a udalosti autofágy. Okrem toho riadi pokrok starnutia a niektoré patológie, ako je rakovina alebo cukrovka.
Biosyntéza
Ľudia a iné zvieratá nie sú schopní syntetizovať izoleucín, ale to je súčasťou bunkových bielkovín vďaka ich získaniu z potravín, ktoré každý deň konzumujeme.
Rastliny, huby a väčšina mikroorganizmov sú schopné syntetizovať túto aminokyselinu z trochu komplexných trás, ktoré sú zvyčajne vzájomne prepojené s rastlinami iných aminokyselín.
Existujú napríklad spôsoby výroby izoleucínu, lyzínu, metionínu a treonínu z aspartátu.
V baktériách sa konkrétne izoleucín vyrába z treonínovej aminokyseliny cez pyruvát cez cestu, ktorá predpokladá kondenzáciu 2 pyruvátových uhlíkov s molekulou a-e-Elektobutirátu, ktorý pochádza z treonínu.
Reakcia začína pôsobením enzýmu dehydratázy, ktorá katalyzuje dehydratáciu treonínu, aby sa vytvoril a-encotobutirát a amónny (NH3). Následne rovnaké enzýmy, ktoré sa podieľajú na biosyntéze valínu, prispievajú k krokom
- Transaminácia
- Oxidačná dekarboxylácia zodpovedajúcich ketoacidov a
- Dehydrogenácia.
V tomto type mikroorganizmov je syntéza aminokyselín, ako je lyzín, metionín, treonín a izoleucín.
Aj keď izoleucín, podobne ako leucín a valín, sú pre človeka esenciálne aminokyseliny, enzýmy aminotransferae prítomné v telesných tkanivách ich môžu reverzibilne vzájomne konvertovať k ich zodpovedajúcim a-Zo-pohotám, ktoré ich nakoniec môžu nahradiť v diéte.
Degradácia
Ako veľká časť aminokyselín, ktoré sú v prírode známe, môže byť izoleucín degradovaný tak, aby tvoril sprostredkovateľov rôznych metabolických trás, medzi ktorými Krebs (ktorý poskytuje najväčšie množstvo koenzýmov, ktoré pracujú na výrobu energie alebo na biosyntézu iných zlúčenín ).
Izoleucín a tryptofán, lyzín, fenylalanín, tyrozín, treonín a leucín sa môžu použiť na produkciu acetyl-CoA, kľúčového metabolického medziproduktu pre viacero bunkových reakcií.
Na rozdiel od iných aminokyselín nie sú aminokyseliny rozvetveného reťazca (leucín, izoleucín a valín) degradované v pečeni, ale sú oxidované ako palivá vo svale, mozgu, obličkách a tukovom tkanive.
Tieto orgány a tkanivá môžu tieto aminokyseliny používať vďaka prítomnosti enzýmu aminotransferázy schopného pôsobiť na tri a produkovať ich zodpovedajúcu aminokyselinu a-ZO.
Akonáhle sa tieto oxidované aminokyselinové deriváty vyrábajú, a-Zo-ketoacidový enzymatický komplex katalyzuje oxidačnú dekarboxyláciu, kde uvoľňuje molekulu oxidu uhličitého (CO2) a produkuje deriváciu aminokyselín aminokyselín.
Patológie súvisiace s metabolizmom izoleucínu
Defekty v metabolizme izoleucínu a iných aminokyselín môžu spôsobiť rozmanitosť podivných a komplexných patológií, ako je choroba „“Javorový sirup moč“(Moč s arce sirupom) alebo rozvetvená reťaz ketoacidúria.
Ako už názov napovedá, toto ochorenie sa vyznačuje charakteristickou arómou moču pacientov, ktorí z neho trpia, okrem zvracania, záchvatov, mentálnej retardácie a predčasnej smrti.
Musí to urobiť konkrétne s chybami enzymatického komplexu a-cethoacid dehydrogenázy, takže aminokyseliny rozvetveného reťazca, ako je izoleucín a jeho oxidované deriváty, sa vylučujú v moču.
Môže vám slúžiť: Tafonomia: História, zachovanie a zmena fosílnychPatológie súvisiace s katabolizmom aminokyselín rozvetveného reťazca, ako je izoleucín.
Potraviny bohaté na izoleucín
Táto aminokyselina je hojná vo svalových tkanivách zvierat, takže mäso živočíšneho pôvodu, ako sú kravy, bravčové mäso, ryby a iné podobné, ako sú jahňacie, kuracie mäso, morčacie, jelene, sú bohaté na rovnaké.
Nachádza sa tiež v mliečnych výrobkoch a jeho derivátoch, ako je syr. Je to v vajec a tiež v rôznych druhoch semien a orechov ako v podstate proteíny, ktoré ich tvoria.
Je hojný v sójových bôboch a hráškoch, ako aj v extraktoch kvasiniek používaných s rôznymi potravinami.
Plazmatické hladiny izoleucínu pre dospelého človeka sú medzi 30 a 108 μmol/l, pre deti a mladí ľudia vo veku 2 a 18 rokov sú medzi 22 a 107 μmol/l a pre dojčatá medzi 26 rokmi medzi 26 rokmi 26 rokov a 86 μmol/l.
Tieto údaje naznačujú, že konzumácia bohatých potravín v tejto a iných príbuzných aminokyselinách je potrebná na udržanie mnohých fyziologických funkcií organizmu, pretože ľudské bytosti nie sú schopné syntetizovať ich novo.
Výhody vášho príjmu
Výživové doplnky s izoleucínom zvyčajne obsahujú ďalšie esenciálne aminokyseliny rozvetveného reťazca, ako je valín alebo leucín alebo iné.
Medzi najbežnejšie príklady spotreby izoleucínom patria výživové doplnky, ktoré používajú športovci na zvýšenie percenta svalovej hmoty alebo syntézy bielkovín. Vedecký základ, na ktorom sú tieto praktiky podporované, sa však neustále diskutuje a ich výsledky nie sú úplne zaručené.
Izoleucín sa však používa na boj proti metabolickým účinkom nedostatku vitamínov (pelagra) charakteristických pre pacientov, ktorí majú bohatú cirok a kukuricu, čo sú potraviny s vysokým obsahom leucínu, ktoré môžu ovplyvniť metabolizmus tryptofánu a kyseliny nikotínovej u ľudí.
Účinky pelagry na experimentálne potkany napríklad zahŕňajú oneskorenia rastu, ktoré sa prekonávajú s doplnením izoleucínu.
- V priemysle živočíšnej výroby
V oblasti výroby zvierat sa aminokyseliny, ako je lyzín, treonín, metionín a izoleucín.
Najmä izoleucín má účinky na asimiláciu dusíka, hoci neprispieva k prírastku hmotnosti týchto hospodárskych zvierat.
- V niektorých klinických podmienkach
Niektoré publikácie naznačujú, že izoleucín je schopný znížiť hladinu glukózy v plazme, takže ich príjem sa odporúča u pacientov trpiacich poruchami, ako je cukrovka alebo nízka miera produkcie inzulínu.
Vírusové infekcie
Suplementácia izooleucín sa ukázala ako užitočná u pacientov infikovaných rotavírusom, ktorí spôsobujú choroby, ako je gastroenteritída a hnačka u malých detí a iných mladých zvierat.
Nedávne štúdie dospeli k záveru, že spotreba tejto aminokyseliny experimentálnymi zvieratami s vyššie uvedenými charakteristikami (infikovanými rotavírusom) pomáha pri raste a výkone vrodeného imunitného systému vďaka aktivácii signalizačných trás PRR alebo receptorov s uznaním rozpoznania rozpoznania rozpoznávania o rozpoznávaní o rozpoznávaní o rozpoznávaní Vzory.
Poruchy nedostatku
Nedostatok izoleucínu môže mať problémy s videním, kožou (ako je dermatitída) a črevá (zrejmé ako hnačka a ďalšie gastrointestinálne prejavy)).
Vzhľadom na skutočnosť, že ide o esenciálnu aminokyselinu pre tvorbu a syntézu hemoglobínu, ako aj pre regeneráciu erytrocytov (krvinky), môžu mať závažné nedostatky izoleucínu závažné fyziologické následky, najmä s anémiou a inými hematologickými bunkami choroby.
Môže vám slúžiť: terciárne spotrebiteliaToto sa experimentálne demonštrovalo u „normálnych“ hlodavcov, ku ktorým bola poskytnutá zlá strava v tomto izoleucíne, ktorý končí vývojom dôležitých anemických obrazov.
Izoleucín sa však podieľa na tvorbe hemoglobínu iba u dojčiat, pretože proteín dospelej ľudskej bytosti nemá dôležité množstvo takejto aminokyseliny; To znamená, že nedostatok izoleucínu je zrejmejší v prvých štádiách vývoja.
Odkazy
- Aders Plimmer, R. (1908). Chemická ústava proteínov. odišiel som. Londýn, UK: Longmans, Green a Co.
- Aders Plimmer, R. (1908). Chemická ústava proteínov. Časť II. Londýn, UK: Longmans, Green a Co.
- Barret, G., & Elmore, D. (2004). Aminokyseliny a peptidy. Cambridge: Cambridge University Press.
- Blau, n., Duran, m., Blaskovics, m., & Gibson, K. (Devätnásť deväťdesiat šiestich). Príručka lekára po laboratórnej diagnostike metabolických chorôb (2. vydanie.).
- Bradford, h. (1931). História objavu aminokyselín. Ii. Prehľad aminokyselín opísaný od roku 1931 ako zložky natívnych proteínov. Pokroky v proteínovej chémii, 81-171.
- Campos-Ferraz, P. L., Bozza, T., Nicastro, h., A loď, do. H. (2013). Odlišné účinky leucínu alebo zmesi aminininokyseliny rozvetveného reťazca (leucín, izoleucín a valín) na rezistenciu na únavu a degradáciu svalov a pečeňových glykogénov, u vycvičených potkanov potkanov. Výživa, 29(11-12), 1388-1394.
- Champe, P., & Harvey, r. (2003). Aminokyseliny aminokyseliny. V Ilustrované recenzie Lippincott: Biochémia (3. Ed., pp. 1-12). Lipincott.
- Chandran, K., & Damodaran, m. (1951). Aminokyseliny a proteíny v tvorbe hemoglobínu 2. Izoleucín. Biochemický časopis, 49, 393-398.
- Chung, a. Siež., & Beames, R. M. (1974). Lysín, treonín, metionín a izoleucínový doplňovanie jačmeňa Peace River pre pestovanie ošípaných. pes. J. Ani. Sci., 436, 429-436.
- DeJong, C., Meijerink, w., Van Berlo, C., Deutz, n., & Soeters, P. (Devätnásť deväťdesiat šiestich). Zostupovaná plazmatická izoleucínová koncentrátory po hornom gastrointenciálnom krčme u ľudí. Črevo, 39, 13-17.
- Edsall, J. (1960). Aminininokyseliny, proteíny a biochémia rakoviny (Zv. 241). Londýn: Academic Press, Inc.
- Encyclopaedia Britannica. (2012). Získané 30. augusta 2019, z https: // www.Britannica.com/veda/izoleucín
- Gelfand, R., Hendler, r., & Sherwin, R. (1979). Sacharidy a metabolizmus požitého bielkovín. Lancet, 65-68.
- Hudson, b. (1992). Biochémia potravinových bielkovín. Springer-Science+Business Media, B.Vložka.
- Kerr, i., Vockley, J., & Gibson, K. M. (2014). Poruchy metabolizmu leucínu, izoleucínu a valínu. V N. Blau (ed.), Sprievodca lekárom po diagnostike, liečbe a sledovaní dedičných metabolických chorôb (PP. 103-141).
- Korman, s. H. (2006). Vrodené chyby degradácie izoleucínu: prehľad. Molekulárna genetika a metabolizmus, 89(4), 289-299.
- Krishnaswamy, K., & Gpalan, c. (1971). Vplyv izoleucínu na pokožku a elektroencefalogram v pellagrate. Lancet, 1167-1169.
- Martin, r. A., & Kirk, K. (2007). Transport esenciálneho výživného izoleucínu v ľudských erytrocytoch infikovaných maláriou parazit plazmodium falciparum. Krv, 109(5), 2217-2224.
- Národné centrum pre biotechnologické informácie. Databáza pubchem. L-izoleucín, CID = 6306, https: // pubchem.Ncbi.NLM.NIH.Gov/compund/l-izoleucín (prístup k augustu. 31, 2019)
- Nuttall, f. Otázka., Schweim, K., & Gannon, m. C. (2008). Účinok perorálne podávaného izoleucínu s glukózou a bez glukózy na koncentrácie glukagónu a glukózy u nediabetických subjektov. Európsky elektronický čas pre klinickú výživu a metabolizmus, 3(4), 152-158.
- Van Berlo, C. L. H., Van de bogaard,. A. J. M., Van der Heijden, m. Do. H., Van eijk, h. M. H., Janssen, m. Do., Bost, m. C. F., & Soeters, P. B. (1989). Je oslobodenie amoniaku neuverase po krvácaní v tráviacom trakte Priznanie úplnej neprítomnosti izoleucínu v hemoglobíne? Štúdia ošípaných. Hepatológia, 10(3), 315-323.
- Vickery, h. B., & Schmidt, C. L. Do. (1931). História objavu aminokyselín. Chemické recenzie, 9(2), 169-318.
- Wolfe, r. R. (2017). Zobrazené reťazce a syntéza svalových proteínov u ľudí: Mýtus alebo realita? Časopis Medzinárodnej spoločnosti športovej výživy, 14(1), 1-7.
- Wu, g. (2009). Aminininokyseliny: metabolizmus, funkcie a výživa. Aminininokyseliny, 37(1), 1-17.
- « Priemyselná ekologická história, ciele, príklady
- Fenylalanínové charakteristiky, funkcie, biosyntéza, jedlo »

