Fenylalanínové charakteristiky, funkcie, biosyntéza, jedlo
- 2877
- 163
- Mgr. Pravoslav Mokroš
Ten Fenylalanín (Phe, F) je jednou z 9 esenciálnych aminokyselín, to znamená, že nie je endogénne syntetizovaný ľudským telom. Vo svojom bočnom reťazci má táto aminokyselina nepolárnu aromatickú zlúčeninu, ktorá ju charakterizuje.
Fenylalanín alebo kyselina p-fenyl-a-amino propiónová propiónová bola prvýkrát identifikovaná v roku 1879 vedcami J. H. Schulze a M. Barbieri z rastliny z rodiny Fabaceae známej ako Lupinus luteus alebo „žltý altramuz“.
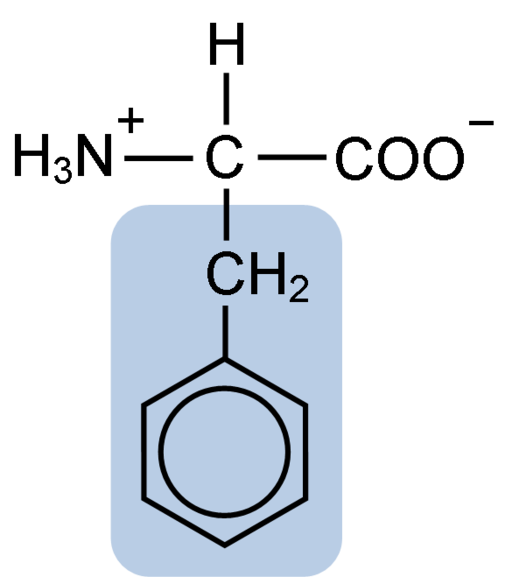
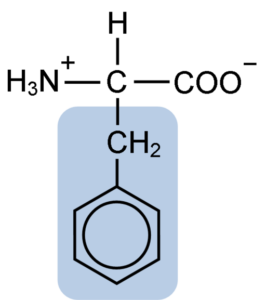 Chemická štruktúra aminokyselinového fenylalanínu (zdroj: klavecín [CC By-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Via Wikimedia Commons)
Chemická štruktúra aminokyselinového fenylalanínu (zdroj: klavecín [CC By-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Via Wikimedia Commons) Dipéptid L-Fenylalanín-L-Aspartil je známy ako aspartám alebo „Nutrasweet“, čo je sladidlo vyrobené synteticky a široko používané v reštauráciách a kaviarňach, zvyčajne na osvetlenie nápojov, ako je káva, čaj, limonáda a ďalšie nápoje.
V plodoch s vyhrievanými charakteristikami je konverzia l-fenylalanínu vo fenolových esteroch, ako je eugenol a jeho metilické deriváty.
V závislosti od formy môže mať fenylalanín rôzne príchute. Napríklad forma L-fenylalanínu má sladkú arómu a chuť, zatiaľ čo D-Fenylalanín je mierne horký a zvyčajne tood.
Pretože má silný hydrofóbny charakter, fenylalanín je jedným z hlavných zložiek mnohých živíc v prírode, ako je napríklad polystyrén. Tieto živice, keď sa dostanú do kontaktu s molekulami vody, tvoria ochrannú alebo pokrytnú štruktúru známu ako „Clatrato“.
Gény, ktoré kódujú cestu biosyntézy fenylalanínu, používajú botanici ako evolučné hodinky, pretože sa zistilo, že tieto súvisia s morfologickou diverzifikáciou suchozemských rastlín.
[TOC]
Vlastnosti a štruktúra
Fenylalanín zdieľanie so všetkými aminokyselinami Karboxylovou skupinou (-COH), aminoskupinou (-NH2) a atómom vodíka (-H), ktoré sú pripojené k centrálnemu atómu uhlíka známeho ako uhlík a. Okrem toho má, samozrejme, bočný reťazec alebo charakteristickú skupinu R.
Fenylalanín je jednou z troch aminokyselín, ktoré majú aromatické alebo benzénové krúžky ako substituenty v laterálnych reťazcoch. Tieto zlúčeniny nie sú polárne, a preto sú vysoko hydrofóbne.
Dotknutá aminokyselina je obzvlášť hydrofóbna, pretože na rozdiel od tyrozínu a tryptofánu (ďalšie dve aminokyseliny s aromatickými kruhmi) nemá amino alebo hydroxylové skupiny spojené so svojím benzénovým kruhom.
Aromatická, benzoická alebo sandylalanínová skupina fenylalanínu má typickú benzénovú štruktúru: cyklický kruh je štruktúrovaný 6 atómami uhlíka, ktoré majú medzi nimi rezonanciu v dôsledku prítomnosti troch dvojitých väzieb a troch jednoduchých väzieb vo vnútri vo vnútri.
Na rozdiel od tyrozínu a tryptofánu, ktorý môže získať kladné a negatívne zaťaženie, fenylalanín si zachováva svoje neutrálne zaťaženie, pretože benzénový kruh nie je ionizovaný a zaťaženie karboxylových a aminokyboviek sa navzájom neutralizujú.
Klasifikácia
Aminokyseliny sa klasifikujú do rôznych skupín podľa charakteristík, ktoré majú svoje bočné reťazce alebo skupiny R, pretože sa môžu meniť veľkosťou, štruktúrou, funkčnými skupinami a dokonca aj v elektrickom náboji.
Ako už bolo uvedené, fenylalanín je klasifikovaný v skupine aromatických aminokyselín, spolu s tyrozínom a tryptofanom. Všetky tieto zlúčeniny majú vo svojej štruktúre aromatické krúžky, avšak tyrozín a tryptofán majú ionizovateľné skupiny v substituentoch svojich skupín R.
Môže vám slúžiť: alopatrická špekulácia: Koncept, proces a príkladyCharakteristiky absorpcie proteínového svetla pri 280 nm vlnovej dĺžke sú spôsobené prítomnosťou aminokyselín klasifikovaných v skupine fenylalanínu, pretože ľahko absorbujú ultrafialové svetlo cez svoje aromatické krúžky.
Ukázalo sa však, že fenylalanín absorbuje oveľa menší pomer ako tyrozín a tryptofán, takže pri analýze niektorých proteínov je jeho absorbancia predvídateľná.
Stereochémia
Všetky aminokyseliny majú centrálny kvirálny uhlík, ktorý má štyri zjednotené atómy alebo skupiny a, ako už bolo povedané, tento atóm je identifikovaný ako uhlík a. Na základe tohto uhlíka je možné nájsť najmenej dva stereoizoméry každej aminokyseliny.
Stereoizoméry sú molekuly so zrkadlovými obrazmi, ktoré majú rovnaký molekulárny vzorec, ale ktoré sa navzájom neprekrývajú, napríklad ruky a nohy. Zlúčeniny, ktoré experimentálne otáčajú pravú polarizovanú svetelnú rovinu, sú označené písmenom D a tie, ktoré to robia vľavo, s písmenom L.
Je dôležité poznamenať, že rozlišovanie medzi d-fenylalanínmi a L-fenylalanínmi je kľúčom k pochopeniu metabolizmu tejto aminokyseliny v tele stavovcov.
Forma L-fenylalanínu sa metabolizuje a využíva na konštrukciu bunkových proteínov, zatiaľ čo D-fenylalanín sa našiel v krvnom obehu ako ochranné činidlo proti reaktívnym druhom kyslíka (ROS).
Funkcia
V 90. rokoch sa predpokladalo, že fenylalanín bol iba u niektorých druhov rastlín. Dnes je však známe, že je prítomný takmer vo všetkých hydrofóbnych doménach proteínov, v skutočnosti je fenylalanín hlavnou zložkou aromatických chemických druhov proteínov.
V rastlinách je fenylalanín nevyhnutnou súčasťou všetkých proteínov; Okrem toho je to jeden zo prekurzorov sekundárnych metabolitov, ako sú fenylpropanoidy (ktoré sú súčasťou pigmentov) obranných molekúl, flavonoidov, biopolymérov, ako je lignín a suberín,.
Fenylalanín je základná štruktúra, ktorá vytvára mnoho molekúl, ktoré udržiavajú neuronálnu homeostázu, medzi ktorými sú peptidy ako vazopresín, melanotropín a encefalín. Okrem toho je táto aminokyselina priamo zapojená do syntézy adrenokortopického hormónu (ACTH).
Rovnako ako väčšina proteínových aminokyselín, aj fenylalanín je súčasťou skupiny ketogénnych a glukogénnych aminokyselín, pretože poskytuje uhlíkovú kostru sprostredkovateľov cyklu Krebs, ktorá je potrebná pre metabolizmus buniek a telesnej energie.
Keď je nadbytok, fenylalanín sa transformuje na tyrozín a následne na fumarát, sprostredkovateľ Krebsovho cyklu.
Biosyntéza
Fenylalanín je jednou z mála aminokyselín, ktoré nemožno syntetizovať väčšinou organizmov stavovcov. V súčasnosti sú pre túto aminokyselinu známe iba biosyntetické trasy v prokaryotických organizmoch, v kvasinkách, v rastlinách a u niektorých druhov húb.
Gény zodpovedné za cestu syntézy sú veľmi zachované medzi rastlinami a mikroorganizmami, preto biosyntéza má podobné kroky takmer u všetkých druhov. U niektorých zvierat sú prítomné aj niektoré enzýmy na trase, ale nie sú schopné ich syntetizovať.
Biosyntéza fenylalanínu v rastlinách
U rastlinných druhov sa fenylalanín syntetizuje vnútornou metabolickou cestou v chloroplastoch známych ako „predetenátová cesta“. Táto trasa je metabolicky spojená s „trasou Shikimato“ cez L-arogenato, jeden z metabolitov vyrobených počas posledného uvedeného.
Môže vám slúžiť: topoizomeráza: Čo sú, charakteristiky, funkcie, typyEnzým inhydratasom Arewood Catalyzuje reakciu s tromi krokmi, v ktorej transformuje aromatický kruh arogenátu na charakteristický benzénny kruh fenylalalanínu.
Tento enzým katalyzuje transamináciu, dehydratáciu a dehydratáciu.
Prednastinu vedľa akumulovaného fenylpyruvátu vo vnútri (svetlo) chloroplastu sa môže previesť na fenylalanín reakciou katalyzovaným enzýmovým aminotransferázou propenato, ktorá prenáša amino skupinu na fenylpyruvát, takže je rozpoznávaná agenátovou dehydratázou a Is incorportované na syntézu fenylalanínu.
U niektorých druhov Pseudomonas Boli opísané alternatívne trasy, ktoré používajú rôzne enzýmy, ale ktorých substráty pre syntézu fenylalanínu sú tiež predeteteátom a arogenátom.
Degradácia
Fenylalanín sa môže metabolizovať niekoľkými spôsobmi z potravy. Najväčšie množstvo štúdií sa však zameriava na ich cieľ na bunkách tkaniva centrálneho nervového a obličkových tkanív.
Pečeň je hlavným orgánom pre degradáciu alebo katabolizmus fenylalanínu. V hepatocytoch je enzým známy ako hydroxyláza fenylalanín, schopný transformovať fenylalanín na tyrozín alebo v zlúčenine L-3,4-dihydroxyfenylalanínu (L-DOPA).
Zlúčenina L-DOPA je prekurzorom norepinefrínu, epinefrínu a iných hormónov a peptidov s aktivitou v nervovom systéme.
Fenylalanín sa môže oxidovať v mozgových bunkách pomocou hydroxylázového tyrozínového enzýmu, ktorý je zodpovedný za katalyzovanie premeny fenylalanínu na dopakróm v prítomnosti kyseliny L-askorbovej.
Predtým sa predpokladalo, že hydroxyláza tyrozín hydroxyláza iba tyrozín, sa však zistilo, že tento fenylalanín a tyrozín hydroxyle v rovnakom pomere a že hydroxylácia fenylalanínu inhibuje hydroxyláciu tyrozín.
V súčasnosti je známe, že vysoké podiely tyrozínu inhibujú enzymatickú aktivitu hydroxylázy tyrozínu, ale to isté nie je pravda pre fenylalanín.
Potraviny bohaté na fenylalanín
Všetky potraviny s bielkovinami majú obsah fenylalanínu medzi 400 a 700 mg pre časť požitého potravy. Potraviny, ako je olej z tresky, čerstvý tuniak, homáre, ustrice a iné lastúry, obsahujú viac ako 1.000 mg na porciu požitého jedla.
Mäso hovädzie a prasa má tiež vysoké hladiny fenylalanínu. Nie sú však také vysoké ako koncentrácie prítomné na morských zvieratách. Napríklad, slanina, hovädzie, pečeňové, kuracie a mliečne výrobky majú medzi 700 a 900 mg fenylalanínu pridelením potravín.
Orechy, ako sú arašidy a orechy rôznych druhov, sú ďalšie potraviny, ktoré majú dobré množstvo fenylalanínu. Zrná, ako sú sójové bôby, cícer a iné strukoviny.
Ako alternatívny zdroj môže byť fenylalanín metabolizovaný z aspartamu.
Výhody vášho príjmu
Fenylalanín sa nachádza vo všetkých potravinách bohatých na bielkoviny, ktoré konzumujeme. Minimálna denná spotreba pre dospelých a priemerná veľkosť je okolo 1 000 mg, potrebná na syntézu bielkovín, hormóny, ako je dopamín, rôznych neurotransmiterov atď.
Môže vám slúžiť: Aká je prirodzená rozmanitosť Zeme?Konzumácia tejto nadbytočnej aminokyseliny je predpísaná pre ľudí, ktorí majú depresívne poruchy, bolesť kĺbov a kožné choroby, pretože jej spotreba zvyšuje syntézu proteínu a prenáša biomolekuly, ako je epinefrín, norepinefrín a dopamín.
Niektoré štúdie naznačujú, že fenylalanín konzumovaný v nadmernom prebytku neprináša významné zlepšenia žiadnej z týchto porúch, ale ich konverzia na tyrozín, ktorý sa používa aj na syntézu signálnych molekúl, môže vysvetliť pozitívne účinky na bunkovú signalizáciu v nervovom systéme v nervovom systéme v nervovom systéme v nervovom systéme v nervový systém.
Lieky formulované proti zápche majú jadrá štruktúrované fenylalanínom, tyrozínom a tryptofánom. Všeobecne tieto lieky obsahujú zmesi týchto troch aminokyselín vo svojich formách l- y d-.
Poruchy nedostatku
Hladiny fenylalanínu v krvi sú dôležité na udržanie správneho fungovania mozgu, pretože fenylalanín, tyrozín a tryptofán sú substrátmi na zostavenie rôznych neurotransmiterov.
Niektoré poruchy sa skôr týkajú deficitov v metabolizme tejto aminokyseliny, ktorá vytvára jej prebytok, namiesto nedostatku.
Fenylcetonúria, nezvyčajné dedičné ochorenie u žien, ovplyvňuje hepatálnu hydroxyláciu fenylalanínu a vytvára plazmatické hladiny tejto aminokyseliny nadmernú, takže je indukovaná neuronálna apoptóza a ovplyvňuje normálny vývoj mozgu.
Ak žena s fenylcetonúriou otehotnie, plod môže prezentovať to, čo je známe ako „materský syndróm plodu“ hyperfenylalanímie ".
Je to preto, že plod má vysoké koncentrácie fenylalanínu v krvi (takmer dvojnásobok štandardov), ktorého pôvod je príbuzný s neprítomnosťou pečeňovej hydroxylázy fenylalanínu plodu, ktorý sa nevyvíja až do 26 týždňov tehotenstva.
Fetálny syndróm materskou hyperfenylalanímiami, produkuje mikrocefálie plodu, opakujúce sa potraty, srdcové choroby a dokonca aj malformácie obličiek.
Odkazy
- Biondi, r., Brancorsini, s., Poli, G., Egidi, m. G., Capodicasa, e., Bottiglieri, L.,… & Micu, r. (2018). Detekcia a vychytávanie hydroxylového radikálu prostredníctvom hydroxylácie d-fenylalanínu v ľudských tekutinách. Talanta, 181, 172-181
- Cho, m. H., Kórea, o. R., Jang, h., Bedgar, D. L., Laskar, D. D., Anterola, a. M.,… & Kang, C. (2007). Biosyntéza fenylalanínu v Thalian Arabidopsis Identifikácia a charakter argenátových dehydratov. Journal of Biological Chemistry, 282 (42), 30827-30835.
- Fernstrom, J. D., & Fernstrom, m. H. (2007). Syntéza a funkcia tyrozínu, fenylalanínu a kacholamínu v mozgu. The Journal of Nutrition, 137 (6), 1539S-1547S.
- Hou, j., Vázquez-González, m., Fadeev, m., Liu, x., LAVI, R., & Willner, i. (2018). Katalyzovaná a elektrokatalyzovaná oxidácia L-tyrozínu a L-fenylalanínu na dopchrome nanozýmmi. Nano listy, 18 (6), 4015-4022.
- Nelson, D. L., Lehninger, a. L., & Cox, M. M. (2008). Lehninger princípy biochémie. Macmillan.
- Perkins, r., & Vaida, V. (2017). Fenylalanín zvyšuje priepustnosť membrány. Journal of American Chemical Society, 139 (41), 14388-14391.
- Plimmer, R. H. Do. (1912). Chemická konštitúcia proteínov (zv. 1). Longmans, zelený.
- Tensley, G. (2018). Zdravotná čiara. Získané 5. septembra 2018, z www.Zdravotná čiara.com/výživa/fenylalanín
- Tohge, t., Watanabe, m., Hoefgen, r., & Fernie,. R. (2013). Biosyntéza shikimatu a fenylalanínu v zelenej línii. Frontiers in Plant Science, 4, 62.
- « Izoleucín charakteristiky, funkcie, biosyntéza, jedlo
- Národné predné charakteristiky, ciele, prezidenti »

