Hydrofóbne interakcie Čo je, význam, príklady
- 2986
- 484
- JUDr. Rudolf Čapkovič
Ten Hydrofóbne interakcie (HI) Sú to sily, ktoré udržiavajú súdržnosť medzi apolárnymi zlúčeninami ponorenými do polárneho roztoku alebo rozpúšťadla. Na rozdiel od iných nekovalentných interakcií, ako sú vodíkové mosty, iónové interakcie alebo van der Waalsové sily, hydrofóbne interakcie nezávisia od vnútorných vlastností rozpustených látok, ale skôr od rozpúšťadiel.
Veľmi ilustratívnym príkladom týchto interakcií môže byť fázová separácia, ktorá sa vyskytuje pri miešaní vody s olejom. V tomto prípade molekuly oleja „vzájomne interagujú“ v dôsledku objednávania molekúl vody okolo nich.
 Emulzia tuku vo vode (Catrin Sohrabi [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)], z Wikimedia Commons)
Emulzia tuku vo vode (Catrin Sohrabi [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)], z Wikimedia Commons) Pojem týchto interakcií existuje už od štyridsiatych rokov. Pojem „hydrofóbne spojenie“ však vytvoril Kauzmann v roku 1959, pričom študoval najdôležitejšie faktory pri stabilizácii trojrozmernej štruktúry určitých proteínov.
Jeho najdôležitejšie nešpecifické interakcie sa uskutočňujú v biologických systémoch. Majú tiež dôležitú úlohu v rôznych inžinierskych aplikáciách a chemickom a farmaceutickom priemysle, ktoré dnes poznáme.
Príčina hydrofóbnych interakcií
Jeho fyzická príčina je založená na neschopnosti apolárnych látok vytvárania vodíkových väzieb s molekulami vody v roztoku.
Sú známe ako „nešpecifické interakcie“, pretože nesúvisia s afinitou medzi molekulami rozpustených látok, ale skôr so tendenciou molekúl vody udržiavať svoje vlastné interakcie pomocou vodíkových väzieb.
Môže vám slúžiť: biosurfaktantyPo kontakte s vodou majú apolárne alebo hydrofóbne molekuly tendenciu spontánne pridávať, aby sa dosiahla väčšia stabilita znížením plochy kontaktného povrchu vodou.
Tento účinok by sa mohol zamieňať so silnou príťažlivosťou, ale nie je to nič viac ako dôsledok apolárneho charakteru látok vo vzťahu k rozpúšťadlu.
Vysvetlené z termodynamického hľadiska, tieto spontánne asociácie sa vyskytujú pri hľadaní energeticky priaznivého stavu, kde máte najmenej voľnú variáciu energie (∆G).
Berúc do úvahy, že ∆G = ∆H - T∆Siež, Najnergeticky najpriaznivejší stav bude stav, v ktorej je entropia (∆Siež) Buďte väčší, to znamená, ak sú menej molekúl vody, ktorých rotačná a translačná sloboda je znížená kontaktom s apolárnou rozpustnou látkou.
Ak sú apolárne molekuly navzájom spojené, vynútené molekulami vody, získa sa priaznivejší stav, ako keby tieto molekuly zostali oddelené, každá obklopená „klietkou“ rôznych molekúl vody.
Biologický význam
Má veľký význam, pretože sa vyskytujú v rozmanitosti biochemických procesov.
Spomedzi týchto procesov patria konformačné zmeny v proteínoch, spojenie enzýmových substrátov, asociácia podjednotiek enzymatických komplexov, agregácia a tvorba biologických membrán, stabilizácia proteínov vo vodných roztokoch a iných.
Z kvantitatívneho hľadiska, rôzni autori dali úlohu určiť, aký je jeho dôležitosť v stabilite štruktúry veľkého množstva proteínu, pričom dospeli k záveru, že tieto interakcie prispievajú k viac ako 50 %.
Môže vám slúžiť: oxidázová glukóza: charakteristiky, štruktúra, funkcieMnoho membránových proteínov (integrálny a periférny) je spojených s lipidovými dvojvrstvami vďaka HI, keď majú tieto proteíny vo svojich štruktúrach hydrofóbne domény. Okrem toho stabilita terciárnej štruktúry mnohých rozpustných proteínov závisí od HI.
Niektoré techniky pri štúdiu bunkovej biológie využívajú vlastnosť, ktorú niektoré iónové detergenty posúvajú.
Mikel sa používajú aj vo farmaceutických štúdiách, ktoré zahŕňajú dodávanie liekov rozpustných v tuku a ich tvorba je tiež nevyhnutná pre absorpciu komplexných vitamínov a lipidov v ľudskom tele.
Príklady hydrofóbnych interakcií
Membrány
Vynikajúcim príkladom HI je tvorba bunkových membrán. Takéto štruktúry sa skladajú z dvojvrstvy fosfolipidov. Vaša organizácia je daná vďaka jeho, ktoré sa vyskytujú medzi apolárnymi chvostmi v „odpudení“ do okolitého vodného prostredia.
Bielkovina
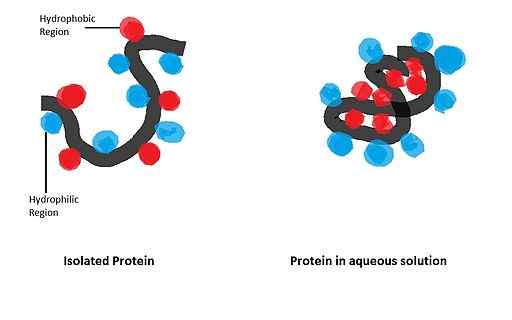
Má veľký vplyv na skladanie guľových proteínov, ktorých biologicky aktívna forma sa získa po vytvorení konkrétnej priestorovej konfigurácie riadenej prítomnosťou určitého odpadu z aminokyselín v štruktúre.
- Prípad apomioglobínu
Apomicoglobín (myoglobín bez skupiny Hemo) je malý alfa-heliidálny proteín, ktorý slúžil ako model na štúdium procesu skladania a dôležitosti jeho apolárneho odpadu v polypeptidovom reťazci toho istého.
V štúdii, ktorú uskutočnili Dyson a spolupracovníci v roku 2006, kde sa použili mutované sekvencie apomioglobínu, sa ukázalo, že iniciácia skladacích udalostí závisí predovšetkým od jeho medzi aminokyselinami s apolárnymi skupinami alfa-helixov.
Môže vám slúžiť: Vzťah medzi hmotou a energiou pozorovanými v bunkovej výživeMalé zmeny zavedené v aminokyselinovej sekvencii teda znamenajú dôležité modifikácie v terciárnej štruktúre, čo vedie k slabo formovaným a neaktívnym proteínom.
Detergenty
Ďalším jasným príkladom je spôsob pôsobenia komerčných detergentov, ktoré používame na domáce účely každý deň.
Detergenty sú amfipatické molekuly (s polárnou oblasťou a ďalším apolárnym). Môžu „emulgovať“ tuk, pretože majú schopnosť tvoriť vodíkové väzby s molekulami vody a majú hydrofóbne interakcie s lipidmi prítomnými v tukoch.
Po kontakte s tukom do vodného roztoku sú detergentné molekuly navzájom spojené takým spôsobom, že apolárne chvosty čelia čelu molekúl lipidov a sú vystavené povrchu mycely polárne oblasti, ktoré vstupujú do vodného kontaktu s kontaktom s vodou.
Odkazy
- Chandler, D. (2005). Rozhrania a hnacia sila hydrofóbnej zostavy. Povaha, 437(7059), 640-647.
- Dyson, J. H., Wright, P. A., & Sheraga, h. Do. (2006). Úloha hydrofóbnych interakcií pri začatí a šírení skladania proteínov. Pnas, 103(35), 13057-13061.

