Indický

- 2003
- 495
- MUDr. Žigmund Boška
 Kovový indický kúsok. Zdroj: Hi-res obrázky chemických prvkov [CC BY (https: // creativeCommons.Org/licencie/o/3.0)]
Kovový indický kúsok. Zdroj: Hi-res obrázky chemických prvkov [CC BY (https: // creativeCommons.Org/licencie/o/3.0)] Čo je Ind?
On Indický Je to kov, ktorý patrí do skupiny 13 periodickej tabuľky a má chemický symbol v. Vaše atómové číslo je 49, 49V a je prezentovaný v prírode ako dva izotopy: 113Dovnútra 115V, posledne menovaný je najhojnejší. Na Zemi sa indické atómy nachádzajú ako nečistoty v zinkových a olovených mineráloch.
Je to konkrétny kov, pretože je najjemnejší, ktorého sa dá dotknúť bez mnohých zdravotných rizík; Na rozdiel od lítia a rubídium, ktoré by pri reagovaní s vlhkosťou strašne spálili pokožku. Kus Indov môže byť nakrájaný nožom a zlomeninou silou prstov, ktorý vydáva výraznú krízu.
Každý, kto počuje o tomto kovu, určite príde na myseľ Indie, ale jeho meno je odvodené z indigovej farby, ktorá sa pozoruje pri vykonávaní testu plameňa. V tomto zmysle vyzerá dosť veľa draslíka, spaľuje jeho kov alebo zlúčeniny s veľmi charakteristickým plameňom, prostredníctvom ktorého bol Ind prvýkrát detekovaný v mineráloch Sfhenset Minerals.
India zdieľa mnoho chemických vlastností s hliník a gallium, ktoré predstavuje vo väčšine zlúčenín s oxidačným počtom +3 (v3+). Výborne sa kombinuje s Galom, ktorý vytvára zliatiny s nízkymi bodmi topenia, pričom jedným z nich je Galinstan.
Indické aplikácie sú založené na výstelke materiálov so zliatinami, vďaka čomu sú elektrické a flexibilné vodiče. Ind má nejaké sklo, aby im poskytol väčšie trblietky a nahradil striebro. Vo svete technológie sa Ind nachádza na dotykových obrazovkách a LCD.
Objavenie
V roku 1863 nemecký chemik Ferdinand Reich hľadal stopy prvku Talio s použitím zelenej línie svojho emisného spektra v mineráloch CINC; Konkrétne vzorky sfaleritu (Zns) okolo Saska. Po toastovaní minerálov, odstránenie obsahu síry, ich strávenie kyselinou chlorovodíkovou a destilovaný chlorid zinočnatia, získal pyžizo zrážanie.
Vzhľadom na toto zistenie sa Reich rozhodla vykonať spektroskopickú analýzu; Ale pretože nemal dobré oči na pozorovanie farieb, išiel k svojmu kolegovi Hariomusovi Theodorovi Richterovi, aby mu pomohol pri tejto úlohe. Richter bol ten, kto pozoroval modrú spektrálnu čiaru, ktorá nezodpovedala spektru žiadneho iného prvku.
Môže vám slúžiť: kyselina jodóza (HIO2): Vlastnosti a použitiaDvaja nemeckí chemici čelili novému prvku, ktorý sa nazýval indická farba pre indigovú farbu plameňa, keď ich zlúčeniny spálili; A potom názov tejto farby odvodzuje z latinského slova Indikácia, Čo znamená India.
O rok neskôr, v roku 1864, nadšené a po dlhodobej sérii zrážok a očistenia, izolovali vzorku kovového Indu elektrolýzou ich rozpustených solí vo vode.
Indická štruktúra
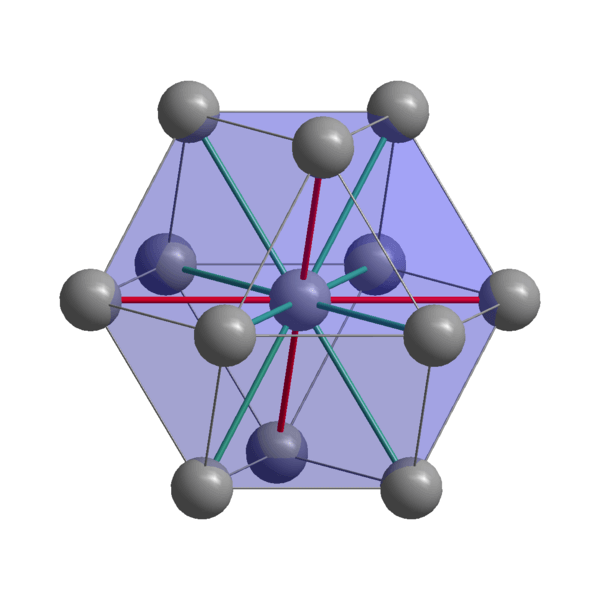 Indická kryštalická štruktúra
Indická kryštalická štruktúra Ind, atómy súdržnosti pomocou svojich valenčných elektrónov na vytvorenie kovovej väzby. Nakoniec sú usporiadané v skreslenej tetragonálnej štruktúre sústredenej na tele. The interactions between the in-In-In-In-neighbor atoms are relatively weak, which explains why the Indian has a low melting point (156 ºC).
Na druhej strane, sily, ktoré zjednocujú dva alebo viac indických kryštálov.
Indické vlastnosti
Fyzický vzhľad
Je to pozoruhodne mäkký strieborný kov. Môže sa roztrhnúť tlakom nechtu, vyrezať nožom alebo poškriabať v jasných ťahoch na liste papiera. Je dokonca možné žuť a deformovať ho zubami, za predpokladu, že je sploštený. Je tiež veľmi ťažký a kladiteľný, má plastové vlastnosti.
Keď indický zahrievaný s baterkou odmietne plameň indigovej farby, ešte jasnejší a farebnejší ako draslík.
Molárna hmota
114,81 g/mol
Bod topenia
156,60 ° C
Bod varu
2072 ° C.
Rovnako ako gal, aj Ind má veľký teplotný interval medzi jeho fúznym bodom a varom. Odráža to skutočnosť, že interakcie In-In v tekutine sú silnejšie ako tie, ktoré prevládajú v skle; A preto je ľahšie získať kvapku Indov ako ich výpary.
 Indická poloha v periodickej tabuľke. Zdroj: Daniel Mayer alebo Vektorizácia Greatpatton: Sushant Savla, CC BY-SA 3.0, cez Wikimedia Commons
Indická poloha v periodickej tabuľke. Zdroj: Daniel Mayer alebo Vektorizácia Greatpatton: Sushant Savla, CC BY-SA 3.0, cez Wikimedia Commons Hustota
Pri izbovej teplote: 7,31 g/cm3
Priamo v bode topenia: 7,02 g/cm3
Elektronegativita
1,78 v Pauling Scale
Ionizačné energie
Prvé: 558,3 kJ/mol
Po druhé: 1820,7 kj/mol
Tretie: 2704 kj/mol
Tepelná vodivosť
81,8 w/(m · k)
Elektrický odpor
83,7 NΩ · m
Mohs tvrdosť
1.2. Je to sotva o niečo ťažšie ako mastenec (nie mätúce húževnatosť).
Reaktivita
Indián sa rozpustí v kyselinách, aby spôsobil solí, ale nerozpustil sa v alkalických roztokoch, a to aj s horúcim hydroxidom draselného. Reaguje v priamom kontakte s síry, kyslík a halogény.
Môže vám slúžiť: riedenie: koncept, ako sa to robí, príklady, cvičeniaInd je relatívne amfoterický, ale správa sa viac ako základ ako kyselina, čo je mierne základné vodné roztoky. V (oh)3 Je redisolve s pridaním ďalších alkalisov spôsobujúcich indické komplexy, v (OH)4-, Rovnako ako v prípade hliníkov.
Elektronická konfigurácia
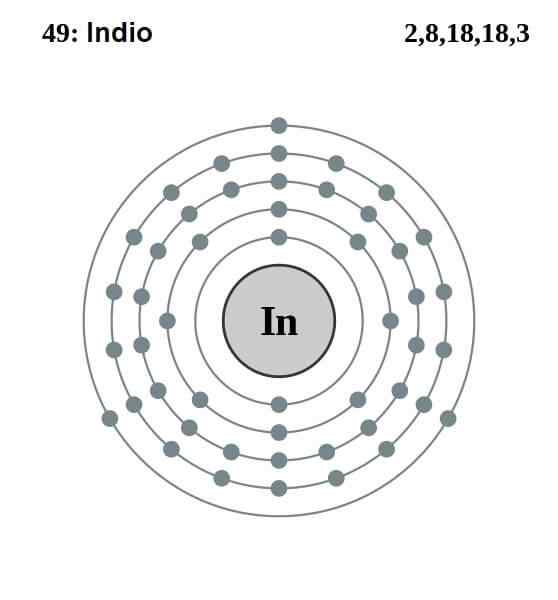 Elektronická indická konfigurácia
Elektronická indická konfigurácia Elektronická konfigurácia Indov je nasledovná:
[KR] 4D10 5s2 5 P1
Z týchto trinástich elektrónov sú posledné tri z orbitálov 5 s a 5p. S týmito tromi elektrónmi indické atómy vytvoria svoju kovovú väzbu, ako to robí hliník a gallium, a tvoria kovalentné väzby s inými atómami.
Oxidácia
Vyššie uvedené sa používa na to, aby stál naraz, že Ind je schopný stratiť svoje tri elektróny vo Valencii, alebo vyhrať päť, aby sa stal izolektronickým xenónom Noble Gas Xenon.
Ak v zlúčenine predpokladáme, že stratil svoje tri elektróny, zostane ako trivalentný katión v3+ (V analógii al3+ a ga3+) a preto vaše oxidačné číslo bude +3. Väčšina indických zlúčenín je v (iii).
Medzi ďalšie oxidačné čísla nájdené pre Indov, ktorých máme: -5 (v5-), -2 (v2-), -1 (v-), +1 (v+) a +2 (v2+).
Niektoré príklady zlúčenín v (i) sú: INF, vrátane Inbr, INI a IN2Ani. Všetky sú relatívne zriedkavé zlúčeniny, zatiaľ čo v (iii) sú prevládajúcimi: v (OH)3, V2Ani3, Viazaný3, Infraje3, atď.
V (i) zlúčeninách sú silné redukčné činidlá, v ktorých v+ Darujte dva elektróny iným druhom, aby sa stali3+.
Izotopy
Ind je v prírode prezentovaný ako dva izotopy: 113Dovnútra 115V ktorých množstvo pôdy je 4,28%, respektíve 95,72%. Preto na Zemi máme oveľa viac atómov 115V tom 113V. On 115V polovičnom živote 4,41 · 1014 roky, také veľké, že sa prakticky považuje za stabilný, napriek tomu, že je rádioizotop.
V súčasnosti bolo vytvorených celkom 37 umelých izotopov Indov, všetky rádioaktívne a veľmi nestabilné. Z všetkých z nich je najstabilnejší 111V tom, čo má polovičný život 2,8 dňa.
Použitie/aplikácie
Zliatiny
Ind s gáliom veľmi dobre vychádza. Oba kovy tvoria zliatiny, ktoré Mel. Ind je tiež ľahko zmarený a má 57% rozpustnosť v ortuti.
Môže vám slúžiť: kyselina octová (CH3COOH)Indické zliatiny sa používajú na navrhovanie strieborných zrkadiel bez toho, aby sa uchýlili k striebre. Keď sa naliavajú na oblasť akéhokoľvek materiálu, pôsobí ako adherent, takže je možné zhromaždiť sklo, kov, kremeň a keramiku.
elektronika
 Bez Indov by dotykové obrazovky nikdy neexistovali
Bez Indov by dotykové obrazovky nikdy neexistovali Ind tiež vychádza s Germanom, takže jeho zlúčeniny sa pridávajú ako doping k germánskemu nitruro LED, reprodukujúce tieto zmesi modré svetlá, fialové a zelené. Je tiež súčasťou tranzistorov, termistorov a fotovoltaických buniek.
Najdôležitejšie z jeho zlúčenín je cín a indický oxid, ktorý sa používa ako sklenená podšívka, ktorá odráža niektoré vlnové dĺžky. To vám umožní používať vo zváraných okuliaroch a v škrabancovom skle, aby sa vo vnútri neohrievali.
Sklenené potiahnuté týmto oxidom sú dobré vodiče elektriny; Ako ten z našich prstov. Preto je určený na výrobu dotykových obrazoviek, ešte viac súčasnej aktivity kvôli vzniku stále viac a viac smartfónov.
Riziká
 Ind v tuhom stave. Zdroj: W. Oelen, CC BY-SA 3.0, cez Wikimedia Commons
Ind v tuhom stave. Zdroj: W. Oelen, CC BY-SA 3.0, cez Wikimedia Commons Indián v prvom rade nepredstavuje žiadne riziko pre životné prostredie, ako je v iónoch v3+ Nie sú šírené vo značných množstvách. Neexistujú žiadne informácie o tom, aký by bol jeho dopad na pôdy, ovplyvňujúci rastliny, ani na faunu alebo more.
V tele nie je známe, či ióny v3+ Majú určitú základnú účasť na metabolizme v stopách sumy. Keď sa však ich zlúčeniny požívajú, sú škodlivé pre niekoľko orgánov, a preto sa považujú za vysoko toxické látky.
V skutočnosti ITO častice (cín a indický oxid, pre svoju skratku v angličtine: Oxid india), nevyhnutné na výrobu obrazoviek pre počítače a smartfóny, môžu negatívne ovplyvniť zdravie pracovníkov, čo im spôsobí chorobu nazývanú indické pľúca.
Príjem týchto častíc sa vyskytuje predovšetkým inhaláciou a kontaktom cez pokožku a oči.
Na druhej strane, jemné kovové indické častice sú náchylné na spaľovanie a spôsobujú požiare, ak sú to zdrojom tepla.

