Holmio

- 4413
- 105
- Tomáš Mydlo
 Vzorka kovového ultrapúru Holm. Zdroj: Hi-RES obrázky chemických prvkov [CC po 3.0 (https: // creativeCommons.Org/licencie/o/3.0)]
Vzorka kovového ultrapúru Holm. Zdroj: Hi-RES obrázky chemických prvkov [CC po 3.0 (https: // creativeCommons.Org/licencie/o/3.0)] Čo je Holmio?
On Holmio Je to kovový prvok patriaci do bloku F periodickej tabuľky, konkrétne do obdobia lantanidov. Je preto členom vzácnych zemín, vedľa Erbio, Itrio, Disposio a Iterbio. Všetky tieto tvoria sériu minerálov (xenotima alebo gadolinita), ktoré je ťažké oddeliť konvenčnými chemickými metódami.
Jeho chemický symbol je Ho, ktorý má atómové číslo 67 a je menej hojný ako jej susedia (likvidio jej susedov (66Dy) a Erbio (68Er). Potom sa hovorí, že odbory Harkins sa poslúžia. Holmius je jedným z tých zriedkavých kovov, ktoré takmer nikto nevie alebo má podozrenie na svoju existenciu; Ani medzi chemikáliami sa zvyčajne nespomína veľmi často.
V oblasti medicíny je Holmio známy tým, že používa jeho laser v operáciách na boj proti patológiám prostaty. Predstavuje tiež sľubný materiál na výrobu elektromagnetov a kvantových počítačov kvôli jeho neobvyklým magnetickým vlastnostiam.
Holmium zlúčeniny, trivalentné, HO3+, Predstavujú zvláštnosť prejavu farby závislej od svetla, s ktorým sú ožarovaní. Ak je to fluorescenčné, farba týchto zlúčenín sa mení zo žltej na ružovú. Podobne sa to stáva s jeho riešeniami.
História
Objav Holmio sa pripisuje dvom švajčiarskym chemikáliám, Marc Defontaine a Jacques-Louis Sora, ktorý bol v roku 1878 detegovaný spektroskopicky pri analýze v Ženevských mineráloch vzácnych zemín. Nazvali mu prvok x.
O rok neskôr, v roku 1879, spravoval švédsky chemik na Teodor Cleve2Ani3). Tento oxid, kontaminovaný inými nečistotami, vykazoval hnedé sfarbenie, ktoré pomenoval „Holmia“, čo znamená mŕtvicu v latinčine.
Môže vám slúžiť: Exergonická reakcia: Charakteristiky a príkladyCleve tiež získal ďalší zelený materiál: „Thulia“, ktorý sa stáva oxidom Tulio. Problém tohto objavu je v tom, že žiadna z troch chemikálií nedokázala získať dostatočnú vzorku oxidu Holm, pretože bol kontaminovaný atómami Docch, ďalší kov lantanidu.
V roku 1886 to nebolo nič iné ako, že francúzska chemikália, Paul Lecoq z Boisbaudran, izolovala oxid Holm frakcionovanými zrážkami. Tento oxid následne podstúpil chemické reakcie na výrobu solí Holmio, ktoré v roku 1911 znížil švédsky chemik Otto Holmberg; A tak sa objavili prvé kovové vzorky Holm.
V súčasnosti však Holmioove ióny, Hol3+, Extrahuje ich chromatografia iónov, namiesto toho, aby sa uchýlila k konvenčným reakciám.
Vlastnosti Holm
 Umiestnenie Holmio v periodickej tabuľke. Zdroj: Vektorizácia: Sushant Savla 05:51, 9. júna 2019 (UTC), CC BY-SA 4.0, cez Wikimedia Commons
Umiestnenie Holmio v periodickej tabuľke. Zdroj: Vektorizácia: Sushant Savla 05:51, 9. júna 2019 (UTC), CC BY-SA 4.0, cez Wikimedia Commons Fyzický vzhľad
Strieborné, mäkké, ťažisko a kovový kov.
Atómové číslo
67 (67Ho)
Molárna hmota
164,93 g/mol
Bod topenia
1461 ° C
Bod varu
2600 ° C
Hustota
Pri izbovej teplote: 8,79 g/cm3
Práve keď sa topí alebo topí: 8,34 g/cm3
Fúzne teplo
17 kJ/mol
Odparovanie
251 kJ/mol
Kapacita moláru
27,15 J/(mol · k)
Elektronegativita
1.23 v Pauling Scale
Ionizačné energie
Prvé: 581,0 kJ/mol (HO+ plyn)
Po druhé: 1140 kJ/mol (HO2+ plyn)
Tretie: 2204 kJ/mol (HO3+ plyn)
Tepelná vodivosť
16,2 w/(m · k)
Elektrický odpor
814 NΩ · m
Oxidácia
HOLM môže byť prezentovaný vo svojich zlúčeninách s nasledujúcimi číslami alebo oxidačnými stavmi: 0, +1 (HO+), +2 (ho2+) a +3 (ho3+). Zo všetkých je +3 zďaleka najbežnejším a najstabilnejším. Preto je HOLM trivalentný kov, ktorý tvorí zlúčeniny (iónové alebo čiastočne iónové), kde sa zúčastňuje ako ión3+.
Môže vám slúžiť: etylacetátNapríklad v nasledujúcich zlúčeninách sa HOLM nachádza s číslom +3 oxidácie: HO2Ani3 (Ho23+Ani32-), Ho (oh)3, Hrot3 (Ho3+Jo3-) a ho2(SW4)3.
Ho3+ A jeho elektronické prechody sú zodpovedné za zlúčeniny tohto kovového vzhľadu hnedo-žltý. Keď však vyžarujú fluorescenčným svetlom, zatáčajú sa ružovej. To isté platí pre ich riešenia.
Izotopy
Holmio je v prírode prezentovaný ako jediný stabilný izotop: 165Ho (100% hojnosť). Existujú však umelé rádioizotopy so značnými polovičnými časmi. Medzi nimi máme:
-163Ho (tón1/2 = 4570 rokov)
-164Ho (tón1/2 = 29 minút)
-166Ho (tón1/2 = 26 763 hodín)
-167Ho (tón1/2 = 3,1 hodiny)
Magnetický poriadok a moment
Holm je paramagnetický kov, ale môže sa stať feromagnetickým pri teplote 19 K, čo vykazuje veľmi silné magnetické vlastnosti. Sa vyznačuje tým, že má magnetický moment (10,6 μB) väčšie medzi všetkými chemickými prvkami, ako aj nezvyčajná magnetická priepustnosť.
Reaktivita
Holm je kov, ktorý za normálnych podmienok nie je oxy príliš rýchly, takže je potrebné stratiť svoj jas. Keď sa však zahrieva zapaľovačom, stáva sa žltkastým, produktom tvorby oxidovej vrstvy:
4 ho + 3 o2 → 2 HO2Ani3
Reaguje s zriedenými alebo koncentrovanými kyselinami, aby spôsobili svoje príslušné soli (dusičnany, sulfáty atď.). A však prekvapivo nereaguje s kyselinou fluorhoorovou, pretože vrstva HOF3 chráni ho pred degradáciou.
Holmio tiež reaguje so všetkými halogénmi, aby vytvorila svoje príslušné halogenurí (HOF3, Hocl3, Hobr3 a hoi3).
Chemická štruktúra
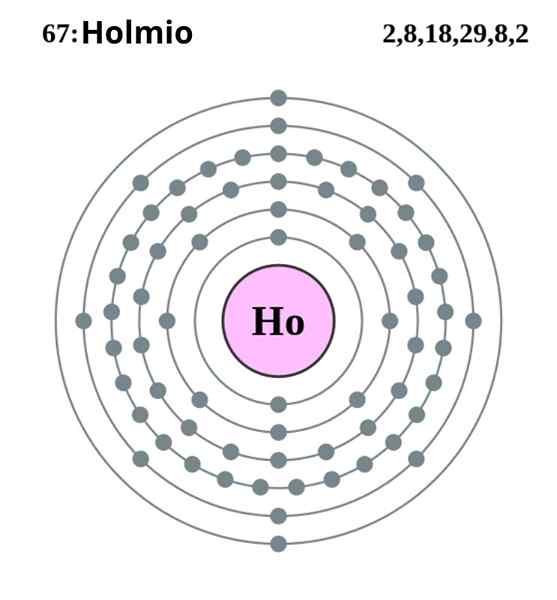 Elektronická konfigurácia Holmio. Zdroj: Pumba (originálna práca Grega Robsona) Creative Commons Share podiel pod rovnakou licenciou 2.0 Anglicko a krajina Walesu
Elektronická konfigurácia Holmio. Zdroj: Pumba (originálna práca Grega Robsona) Creative Commons Share podiel pod rovnakou licenciou 2.0 Anglicko a krajina Walesu Holmio kryštalizuje v kompaktnej šesťuholníkovej štruktúre, HCP (pre jej skratku v angličtine: úzko balené šesťuholník). Teoreticky zostávajú atómy HO kohézne vďaka kovovej väzbe vytvorenej elektrónmi svojich orbitálov 4F, podľa ich elektronickej konfigurácie:
Môže vám slúžiť: riedenie: koncept, ako sa to robí, príklady, cvičenia[Xe] 4fjedenásť 6s2
Takéto interakcie, ako aj energetický systém jeho elektrónov, definujú fyzikálne vlastnosti Holmio. Tento kov nie je známy žiadny iný ALOTROPE alebo Polymorph, ani pod vysokými tlakmi.
Žiadosti
Jadrové reakcie
Atóm Holmio je dobrý absorbent neutrónov, takže pomáha kontrolovať vývoj jadrových reakcií.
Spektroskopia
Roztoky oxidu Holmio sa používajú na kalibráciu spektrofotometrov, pretože ich absorpčné spektrum takmer vždy zostáva, bez ohľadu na nečistoty, ktoré obsahuje. Vykazuje tiež veľmi charakteristické akútne pásma spojené s atómom Holmio, a nie jeho zlúčeninami.
Farbivový
Atómy Holmio sú schopné poskytovať červenkasté sfarbenie skla a umelé drahokamy kubických obvodov.
Magnety
Pri extrémne nízkych teplotách (30 k alebo menej) vykazuje Holmius zaujímavé magnetické vlastnosti, ktoré sa používajú na výrobu výkonných elektrómov, kde pomáha koncentrovať výsledné magnetické pole.
Takéto magnetické materiály sú určené na jadrovú magnetickú rezonanciu; na rozvoj pevných diskov so spomienkami, ktoré oscilujú v poradí petabajtov alebo terabajtov; a prípadne vyrábať kvantové počítače.
Holmio laser
ITITRIO-aluminum granátový kryštál (YAG) môže dopingovať atómami Holmio, aby sa vyžarovalo žiarenie, ktorého vlnová dĺžka je 2 μm; To znamená, že máme holm laser. Vďaka nemu môže byť nádorové tkanivo prerezané presne bez toho, aby spôsobilo krvácanie, pretože energia dodávala rany okamžite rany.
Tento laser sa opakovane používa pri operáciách prostaty a zubov, ako aj na odstránenie rakovinových buniek a obličkových kameňov.

