Štruktúra hydroxidu sodného (NaOH), vlastnosti, použitie, syntéza

- 1550
- 39
- Adrián Fajnor
On hydroxid sodný Je to anorganická zlúčenina, ktorej chemický vzorec je NaOH a pozostáva z veľmi silnej kovovej bázy alebo alkali. 5 %roztok vo vode má pH takmer 14.
Je to veľmi hygroskopická biela tuhá látka a ktorá môže tiež absorbovať oxid uhličitý vzduchu za vzniku uhličitanu sodného. Komerčne sa dodáva v plastových fľašiach, ako sú tabletky, ktoré nemôžu byť vo vzduchu príliš veľa času, ani by s nimi nemalo manipulovať s špachtľami.
 Tablety s obsahom hydroxidu sodného na hodinovom pohári. Zdroj: K dispozícii nie je žiadny stroj na čítanie stroja. Walkerma predpokladala (na základe nárokov na autorské práva). [Verejná doména]
Tablety s obsahom hydroxidu sodného na hodinovom pohári. Zdroj: K dispozícii nie je žiadny stroj na čítanie stroja. Walkerma predpokladala (na základe nárokov na autorské práva). [Verejná doména] Hydroxid sodný sa môže syntetizovať pri reakcii hydroxidu vápenatého s uhličitanom sodným. V súčasnosti je zásadne syntetizovaný elektrolýzou soľanky a je sekundárnym produktom výroby chlóru plynu.
Poskytnúť. Používa sa tiež na čistenie domácnosti, úpravu vody, spracovanie hliníka, výroba liekov atď.; A predovšetkým je to sekundárny vzor par excellence.
Hydroxid sodný je veľmi korozívny, je schopný produkovať podráždenie a popáleniny pokožky a oči. Vdýchnutím prachu môže spôsobiť pľúcny edém. Medzitým môže jeho požitie spôsobiť také vážne zranenia tráviaceho traktu, ktoré môžu viesť k smrti.
[TOC]
Štruktúra
Bezvodý
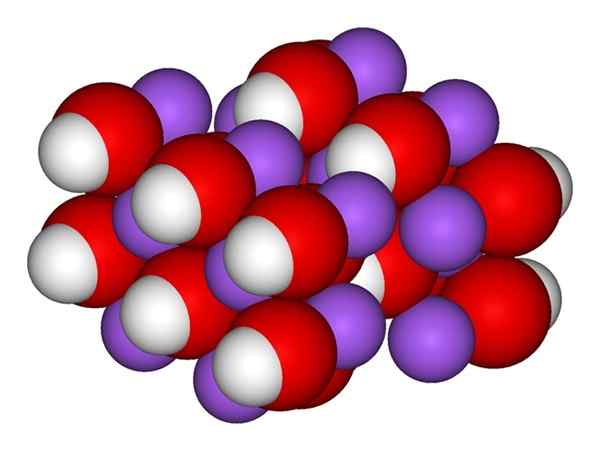
 Ióny. Zdroj: Gabriel Bolívar.
Ióny. Zdroj: Gabriel Bolívar. Vynikajúci obrázok zobrazuje ióny, ktoré tvoria naoh. Katión+ Je reprezentovaný fialovou guľou, zatiaľ čo hydroxyl anión (hydroxid alebo oxydril) OH- Pre červenú a bielu guľu. Oba ióny+ a oh- interagujú medzi sebou elektrostatickou príťažlivosťou svojich opačných zaťažení.
 Štruktúra hydroxidu sodného
Štruktúra hydroxidu sodného Takéto interakcie nie sú smerové, takže príťažlivosť iónového na+Oh- môže ovplyvniť ostatných v určitej vzdialenosti. Výsledkom je, že na ióny+ Odrazujú sa rovnako ako OH-, Až do definovania minimálneho energetického kryštálu, v ktorom stanovia usporiadanú a periodickú štruktúru (kryštalickú).
Preto sa javí ako orcombické kryštály anhydra NaOH (bez vody):
 Reprezentácia kryštalickej štruktúry bezvodého hydroxidu sodného. Zdroj: Quibik cez Wikipedia.
Reprezentácia kryštalickej štruktúry bezvodého hydroxidu sodného. Zdroj: Quibik cez Wikipedia. Ióny zostávajú dostatočne súdržné na to, aby bol bezvodný kryštál NaOH na báze 323 ° C (za predpokladu, že v prostredí nie je žiadna vlhkosť).
Hydráty
Obidve na+ Ako oh- Sú to ióny, ktoré ľahko molekuly vody solvetán (hydrát) ľahko. To uprednostňuje jeho hydratáciu nad retikulárnou energiou jej kryštálov, takže NaOH uvoľňuje veľa energie, keď príde do kontaktu s vodou.
Môže vám slúžiť: Fehlingova reakcia: prípravy, aktívne agenti, príklady, použitiaAvšak bezvodé kryštály môžu hosťovať molekuly vody bez rozpustenia; to znamená, že hydroxid sodný môže tvoriť početné hydráty, naoh · nh2Ani. Molekula vody môže dobre tvoriť vodíkový most s OH- (Hoh-oh-) alebo koordinujte s NA+ (Na+-Oh2).
V závislosti od molárneho pomerania medzi NaOH a H2Alebo môžu vzniknúť monohydráty (NaOH · H2O), dihydráty (NaOH · 2H2O), trihemacrates (NaOH · 3.5H2O), tetrahydráty (NaOH · 4H2O), heptahridates (NaOH · 7h2O) a ďalšie.
Každá z týchto hydrátov môže kryštalizovať z vodného roztoku NaOH s rôznymi hmotnými percentami a pri rôznych teplotách. V dôsledku toho vykazuje zložitý diagram rozpustnosti vo vode.
Hydrátové kryštály sú vo všeobecnosti menej husté a majú nižšie body topenia. Je to preto, že molekuly vody „bránia“ interakcie medzi Na+ a oh-, Pridanie dipólových dipólových síl v obete iónových atrakcií.
Fyzikálne a chemické vlastnosti
Mená
Preferované meno IUPAC: Hydroxid sodný. Ostatné názvy: žieravá sóda, Ascarita (menej bežná)
Molárna hmota
39,9971 g/mol
Vzhľad
Pevné alebo biele, serózne alebo nepriehľadné kryštály.
Bod topenia
323 ° C
Bod varu
1.388 ° C
Rozpustnosť
1.000 g/l pri teplote 25 ° C. To ukazuje, koľko sa môže rozpustiť vo vode.
Jeho vodné roztoky sú viskózne, pričom hodnota viskozity je takmer osemdesiatkrát väčšia ako hodnota vody a na začiatku uvoľňuje veľmi teplo. Ak s nimi máte kontakt, otáčajú klzkú pokožku kvôli zubúžke mastných kyselín pokožky.
Základnosť (PKB)
- 0,56
pH
5 % P/P roztok vo vode má pH takmer 14
Index lom (ND)
Pri vlnovej dĺžke 580,4 nm: 1 433 až 320 ° C a 1 421 až 420 ° C.
Stabilita
Kontajnery, ktoré ho obsahujú, musia byť pevne uzavreté, aby sa zabránilo tvorbe uhličitanu sodného. Je to kvôli jeho vysokej hygroskopicite, čo ju vedie k absorbovaniu vlhkosti svojho prostredia a jeho kontenzity2.
Rozklad
Keď sa zahrieva na rozklad, vydáva dym z oxidu sodného.
Samoliečba
Nie je to horľavé
Hrebeň
4,0 CPoise pri 350 ° C
Odparovanie
175 kJ/mol A 1.388 ° C
Povrchové napätie
74,35 Dynas/cm v roztoku 2,72 % P/P vo vode pri 18 ° C.
Reaktivita
S kyselinami
Reaguje s organickými a anorganickými minerálnymi kyselinami, čo spôsobuje vodu a zodpovedajúcu soľ. V prípade kyseliny sírovej je reakcia exotermická.
Môže vám slúžiť: sulfid hliníka (AL2S3): Štruktúra, vlastnosti, použitia2 naoh+h2SW4 => Na2SW4 + 2 h2Ani
S kyslými oxidmi
Reaguje napríklad oxidom siričitého, ktorý dáva soľ sulfitu a vody:
2 naoh +So2 => Na2SW3 + H2Ani
S kovmi
Jeho vodné roztoky reagujú s niektorými kovmi, aby spôsobili komplexné sodné soli. Napríklad jeho reakcia zo zinku vedie k zinku sodíka:
Zn + 2 NaOH + 2 h2O => na2[Zn (OH)4] + H2
Syntéza
Hydroxid sodný je syntetizovaný hlavne dvoma metódami: použitie uhličitanu sodného, ktorý sa pôvodne používa a elektrolýza chloridu sodného, v súčasnosti väčšie priemyselné použitie.
Reakcia uhličitanu sodného a hydroxid vápenatý
Uhličitan sodný reaguje s hydroxidom vápenatého v procese známeho ako kaustifikácia:
CA (OH)2 + Nat2Co3 => Caco3 + Naoh
Zráža sa uhličitan vápenatý a ponecháva hydroxid sodný v supernatante, ktorý je koncentrovaný odparovaním.
Uhličitan sodný predtým pochádza z procesu Solvay:
2 NaCl+ Caco3 => Na2Co3 + Kacl2
Elektrolýza chloridu sodného
Elektrolyza chloridu sodného, prítomná v soľnici, produkuje plynný vodík, plynný chlorid a hydroxid sodný vo vodnom roztoku:
2 NaCl+2 h2O => h2 + Cl2 + 2 NaOH
Elektrolytická komora pozostáva z priestoru, kde anóda (+), titánového kovu a miesta, kde je soľanka umiestnená. Táto priehradka je oddelená od katódovej priehradky (-) pomocou poréznej membrány.
Pri anóde nastáva nasledujúca reakcia:
2 cl- => Cl2 + 2 e- (Oxidácia)
Medzitým sa táto reakcia vyskytuje v katóde:
2 h2O +2 e- => H2 + Oh- (redukcia)
Sodík (NA+) difúzne od anódového kompartmentu k katóde cez membránu, ktorá ich oddeľuje a vytvára hydroxid sodný.
Žiadosti
Čistiace produkty
Hydroxid sodný sa používa na výrobu mydiel a detergentov používaných doma a v komerčnej činnosti. Kombinácia hydroxidu sodíka a chlóru produkuje bielidlo chlóru, ktoré sa používa v bielom odevnom umývaní.
Eliminuje tiež akumuláciu tuku v odtokoch, čím sa jeho eliminácia konverziou na mydlá prostredníctvom procesu oddrovania. To umožňuje odstránenie prekážky domácich potrubí a iných budov.
Farmaceutické a liečivé výrobky
Hydroxid sodný sa používa pri vypracovaní bežných analgetík, ako je aspirín. Tiež liekov s antikoagulantným účinkom, ktoré blokujú tvorbu krvných zrazenín a liekov na zníženie hypercholesterolémie.
Energetické procesy
Hydroxid sodný sa používa pri výrobe palivových článkov, ktoré fungujú ako batérie na výrobu elektriny pre rôzne aplikácie vrátane prepravy. Epoxidové živice, vyrobené s intervenciou hydroxidu sodného, sa používajú vo veterných turbínach.
Môže vám slúžiť: galvanická korózia: mechanizmy, príklady, ochranaÚprava vody
Hydroxid sodný sa používa na neutralizáciu kyslosti vody a prispieva k odstráneniu jej ťažkých kovov. Používa sa tiež na výrobu chlórnanu sodného, dezinfekčný dezinfekčný prostriedok.
Hydroxid sodný reaguje s hliníkovým síranom na tvorbu hydroxidu hlinitého: flokulačné činidlo používané vo vodných úpravách na zvýšenie sedimentácie častíc, čím sa jeho objasňuje.
Výroba papiera
Hydroxid sodný sa používa so sulfidom sodným pri liečbe dreva na získanie celulózy takmer čistým spôsobom, ktorý tvorí základňu papiera. Používa sa tiež pri recyklácii papiera, pretože tým, že pomáha oddeliť atrament, nám umožňuje znova ho používať.
Priemyselná výroba
Hydroxid sodný sa používa na výrobu Rayón, spandex, výbušniny, epoxidové živice, sklo a keramiku. Používa sa v textilnom priemysle pre farbivá a spracováva bavlnené tkaniny.
V úpravách cukrovej trstiny sa na výrobu bagazo cukrovej trstiny používa nízkoteplotný hydroxid sodný.
Riziká
Hydroxid sodný je vysoko korozívna zlúčenina, takže môže spôsobiť kontakt s pokožkou, popáleninami, ampulmi a dokonca aj trvalými jazvami.
V kontakte s očami môže produkovať vážne popáleniny, opuch, bolesť, rozmazané videnie a v ťažkých prípadoch to môže spôsobiť trvalú slepota.
Požitie hydroxidu sodného môže spôsobiť popáleniny pier, jazyka, hrdla, pažeráka a žalúdka. Medzi obvyklé príznaky sa prejavujú nevoľnosť, zvracanie, kŕče žalúdka a hnačka.
Aj keď je inhalácia hydroxidu sodného, ktorá je zriedkavá a môže sa vyskytnúť iba v dôsledku prítomnosti zloženého prachu vo vzduchu alebo tvorbou rosy, ktorá ho obsahuje, vytvára podráždenie v pľúcach.
V prípade chronickej expozície to môže spôsobiť pľúcny edém a silné dýchacie skrátenie, ktoré predstavuje lekársku pohotovosť.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Wikipedia. (2019). Hydroxid sodík. Zdroj: In.Wikipedia.orgán
- Národné centrum pre biotechnologické informácie. (2019). Hydroxid sodík. Databáza pubchem. CID = 14798. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Americké prvky. (2019). Roztok hydroxidu sodného. Zdroj: Američania.com
- Fakty o chemickej bezpečnosti. (2019). Hydroxid sodík. Získané z: ChemicalSaFetyFacts.orgán
- NJ Zdravie. (2015). Hydroxid sodík. [PDF]. Získané z: NJ.Vláda
- Kanadské centrum pre zdravie a bezpečnosť pri práci. (2019). OSH Odpovede Faktové listy: Hydroxid sodný. Získané z: COHS.Ac
- Ausetute. (s.F.). Produkcia hydroxidu sodného a chlóru elektrolýzou. Získané z: ausetetute.com.Au
- « Pôvod jazyka chol, vlastnosti, kde sa hovoríte, slová
- Charakteristiky indexovaných časopisov, kritériá, vplyvné príklady »

