Štruktúra hydroxidu ortuti, vlastnosti, použitia, riziká
- 1212
- 322
- Mgr. Pravoslav Mokroš
On Hydroxid ortuti Je to anorganická zlúčenina, v ktorej má ortuťový kov (HG) oxidačné číslo 2+. Jeho chemický vzorec je HG (OH)2. Tento druh však ešte nebol získaný v tuhej podobe za normálnych podmienok.
Hydroxid hydroxidu ortuti alebo ortuťový. Pre štúdie uskutočňované v roztokoch oxidu oxidu HGO, bolo odvodené, že HG (OH)2 Je to slabá základňa. Iné druhy, ktoré ho sprevádzajú, sú Hgoh+ a HG2+.
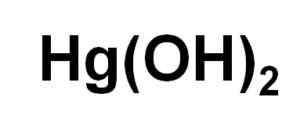 Chemický vzorec ortuťového hydroxidu (II). Autor: Marilú Stea.
Chemický vzorec ortuťového hydroxidu (II). Autor: Marilú Stea. Napriek tomu, že nedokáže byť vyzrážaný vo vodnom roztoku, HG (OH)2 Získala sa fotochemickou reakciou ortuti s vodíkom a kyslíkom pri veľmi nízkych teplotách. Bola tiež získaná vo forme koprecipitovaného spolu s Faith (OH)3, kde prítomnosť haluro iónov má vplyv na pH, v ktorom dochádza.
Pretože na laboratórnej úrovni sa ľahko nezískal čisto, nebolo možné nájsť pre túto zlúčeninu žiadnu užitočnosť alebo určiť riziká jeho použitia. Môže sa však odvodiť, že predstavuje rovnaké riziká ako ostatné zlúčeniny ortuti.
[TOC]
Molekula
Štruktúra ortuťového hydroxidu (II) Hg (OH)2 Je založená na lineárnej centrálnej časti tvorenej atómom ortuti s dvoma atómami kyslíka do bokov.
Atómy vodíka sú spojené s touto centrálnou štruktúrou, každá vedľa každého kyslíka, ktorý sa voľne otáča okolo každého kyslíka. Mohlo by to byť znázornené jednoduchým spôsobom, ako je uvedené nižšie:
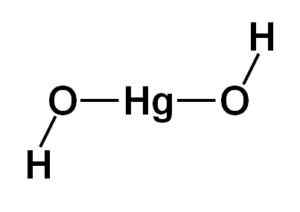 Teoretická štruktúra ortuťového hydroxidu (II). Autor: Marilú Stea
Teoretická štruktúra ortuťového hydroxidu (II). Autor: Marilú Stea Elektronická konfigurácia
Elektronická štruktúra kovovej ortuti HG je nasledovná:
[Xe] 5d10 6siež2
kde [XE] je elektronická konfigurácia xenónu vznešeného plynu.
Pri pozorovaní tejto elektronickej štruktúry je odvodené, že najstabilnejší oxidačný stav ortuti je ten, kde sa stratia 2 elektróny vrstvy 6siež.
V Hg (OH) orturickom hydroxidu2, Atóm ortuti (HG) sa nachádza vo svojom oxidačnom stave 2+. Preto v HG (OH)2 Ortuť má nasledujúcu elektronickú konfiguráciu:
Môže vám slúžiť: 30 použití karboxylových kyselín v každodennom živote[Xe] 5d10
Menovanie
- Ortuťový hydroxid (II)
- Orturový hydroxid
- Dihydroxid ortuti
Vlastnosti
Molekulová hmotnosť
236,62 g/mol
Chemické vlastnosti
Podľa konzultovaných informácií je možné, že HG (OH)2 Byť prechodnou zlúčeninou pri tvorbe HGO v alkalickom vodnom médiu.
Pridanie hydroxylových iónov (OH-) do vodného roztoku s ortuťovými iónmi hg2+ Vedie k zrážaniu žltého tuhého oxidu ortuti (ii) HGO, z ktorého Hg (OH)2 Je to cestujúci alebo dočasný agent.
 Oxid ortuti (II). Leiem [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikipedia Commons.
Oxid ortuti (II). Leiem [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikipedia Commons. Vo vodnom roztoku Hg (OH)2 Je to veľmi krátky životný sprostredkovateľ, pretože rýchlo uvoľňuje molekulu vody a vyzráža pevnú HGO.
Aj keď nebolo možné vyzrážať hydroxid ortuť HG (OH)2, Oxid ortuť (II) HGO je niečo rozpustné vo vode tvoriacim roztoku druhov nazývaných „hydroxidy“.
Tieto druhy vo vode nazývané „hydroxidy“ sú slabé základne a hoci sa niekedy správajú ako amfotolácie, všeobecne HG (OH)2 Je to viac základné ako kyselina.
Keď sa HGO rozpustí v HCLO4 Štúdie naznačujú prítomnosť ortuťového iónu Hg2+, Hgoh monohydroximercuro ión+ a Hg (OH) orturový hydroxid2.
Zostatky, ktoré sa vyskytujú v takýchto vodných roztokoch, sú nasledujúce:
Hg2+ + H2Alebo ⇔ hgoh+ + H+
Hgoh+ + H2Alebo ⇔ hg (oh)2 + H+
V NaOH alkalických roztokoch sa vytvára druh HG (OH)3-.
Získanie
Čistý hydroxid ortuti
Ortuťový hydroxid (ii) Hg (OH)2 Nedá sa získať vo vodnom roztoku, pretože pridaním alkálie k roztoku hg obchodných iónov2+, Zráža sa žltý oxid ortuť.
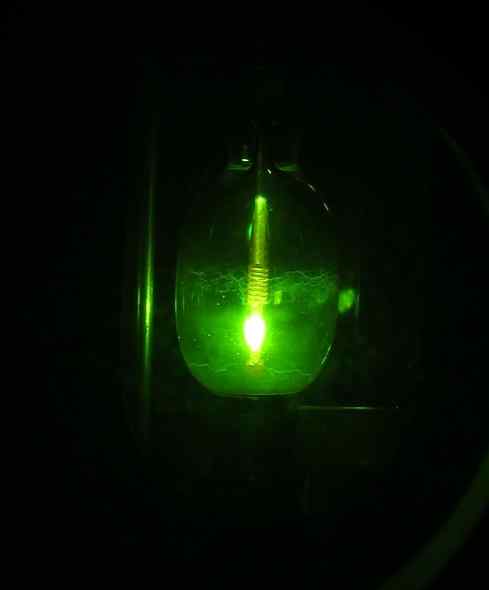
Niektorým vedcom sa však podarilo získať v roku 2005 prvýkrát HG (OH) orturový hydroxid2 Použitím osvetlenia ortuťového oblúka, počnúc prvkom Mercury HG, vodíka H2 a kyslík alebo2.
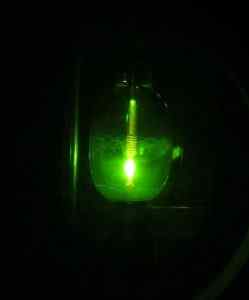 Ortuťová lampa. D-Kuru [CC BY-SA 2.0 at (https: // creativeCommons.Org/licencie/By-SA/2.0/at/skutok.in)]. Zdroj: Wikipedia Commons.
Ortuťová lampa. D-Kuru [CC BY-SA 2.0 at (https: // creativeCommons.Org/licencie/By-SA/2.0/at/skutok.in)]. Zdroj: Wikipedia Commons. Reakcia je fotochemická a uskutočňovala sa v prítomnosti neónu, argónu alebo tuhého deutéria pri veľmi nízkych teplotách (asi 5 K = 5 stupňov Kelvin). Dôkaz tvorby zlúčeniny sa získal pomocou IR absorpcie svetla (infračervené).
Môže vám slúžiť: Zráža saHg (OH)2 Týmto spôsobom je pripravený za podmienok skúseností veľmi stabilný. Odhaduje sa, že fotochemická reakcia prebieha prostredníctvom sprostredkovateľa O-HG-O na stabilnú molekulu H-O-HG-O-H.
Coprecipitácia s hydroxidom železa (III)
Ak sa rozpustí HGSO ortuťového sulfátu (II)4 a železný sulfát (iii) viera2(SW4)3 V kyslom vodnom roztoku a pH sa začína zvyšovať pridaním roztoku hydroxidu sodného NaOH, po vytvorení odvodeného tuhej látky je vytvorenie tuhej látky Coprecipitované Hg (OH)2 a viera (oh)3.
Zistilo sa, že tvorba Hg (OH)2 Je to kritický krok v tomto koprecipitácii s Faith (OH)3.
Tvorba Hg (OH)2 V zrazenej viere (Oh)3-Hg (oh)2 Silne závisí od prítomnosti iónov, ako je fluorid, chlorid alebo bromid, na špecifickej koncentrácii týchto a pH roztoku.
V prítomnosti fluoridu (f-), PH väčšie ako 5, koprecipitácia Hg (OH)2 S vierou (oh)3 nie je ovplyvnený. Ale na pH 4 tvorba komplexov medzi HG2+ a f- interferuje do koprecipitácie HG (OH)2.
V prípade prítomnosti chloridu (Cl-), Koprecipitácia Hg (OH)2 Vyskytuje sa na pH 7 alebo väčšie, to znamená, najlepšie v alkalickom médiu.
Keď je bromid prítomný (BR-), Koprecipitácia Hg (OH)2 Sa objavuje pri ešte väčšom pH, tj pH nad 8,5 alebo viac alkalickým ako pri chloridu.
Žiadosti
Z preskúmania dostupných zdrojov informácií z toho vyplýva, že ortuťový hydroxid (ii) Hg (OH)2, Keďže je zlúčeninou, ktorá sa zatiaľ komerčne pripravuje, nemá známe použitie.
Nedávne štúdie
Prostredníctvom výpočtových simulačných techník v roku 2013 sa študovali štrukturálne a energetické charakteristiky týkajúce sa hydratácie HG (OH)2 V plynnom stave.
Kovová ligando koordinácia a solvatačné energie boli vypočítané a porovnané zmenou stupňa hydratácie Hg (OH)2.
Okrem iného sa zistilo, že teoretický oxidačný stav je zjavne 1+ namiesto údajného 2+, ktorý je zvyčajne pridelený pre HG (OH)2.
Môže vám slúžiť: teoretický výkonRiziká
Aj keď HG (OH)2 Ako taký nebol izolovaný v dostatočnom kvantici.
Môže byť toxický pre nervový systém, tráviaci systém, kožu, oči, dýchací systém a obličky.
Vdýchnutie, požitie alebo kontakt s kožou zlúčenín ortuti môže spôsobiť poškodenie od podráždenia očí a kože, nespavosti, bolesti hlavy, triaskov, poškodenia črevného traktu, straty pamäte, po renálnu insuficienciu, medzi inými príznakmi, medzi inými príznakmi, medzi inými príznakmi.
Ortuť bola medzinárodne uznávaná ako znečisťujúca látka. Väčšina zlúčenín ortuti, ktoré prichádzajú do kontaktu s prostredím, sú metylované baktériami prítomnými v pôdach a sedimentoch, ktoré tvoria metylmercury.
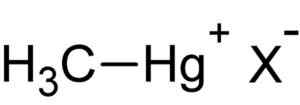 Metylmercury hal. Autor: Nahrané používateľom: Rifleman 82. Zdroj: Neznáme. Zdroj: Wikipedia Commons.
Metylmercury hal. Autor: Nahrané používateľom: Rifleman 82. Zdroj: Neznáme. Zdroj: Wikipedia Commons. Táto zlúčenina je bioakcumula v živých organizmoch, prechádza zo zeme na rastliny a odtiaľ k zvieratám. Vo vodnom prostredí je prenos ešte rýchlejší a v krátkom čase prechádza z veľmi malých druhov na veľký druh.
Metylmercury má toxický účinok na živé bytosti a najmä pre človeka, ktorý ju požíva prostredníctvom potravinového reťazca.
Pri požití jedlom je obzvlášť škodlivé pre malé deti a plody u tehotných žien, pretože neurotoxín môže spôsobiť poškodenie mozgu a nervový systém pri tvorbe a raste.
Odkazy
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.
- Wang, Xuefeng a Andrews, Lester (2005). Infračervené spektrum HG (OH)2 v pevnom neóne a argóne. Anorganic Chemistry, 2005, 44, 108-113. Získané z krčiem.ACS.orgán.
- Amaro-Estrada, J.Jo., a kol. (2013). Vodná solvatácia Hg (OH)2: Energické a dynamické štúdie funkčnej teórie hustoty HG (OH)2-(H2Buď)n (N = 1-24) štruktúry. J. Fyzický. Chem. Do roku 2013, 117, 9069-9075. Získané z krčiem.ACS.orgán.
- Inoue, Yoshikazu a Munemori, Makoto. (1979). Coprecipitácia ortuti (II) s hydroxidom železa (III). Environmentálna veda a technológia. Zväzok 13, číslo 4, apríl 1979. Získané z krčiem.ACS.orgán.
- Chang, L.W., a kol. (2010). Nervový systém a behaviorálna toxikológia. V porozumení toxikológie. Zotavené z vedeckých pracovníkov.com.
- Haney, Alan a Lipsey, Richard L. (1973). Akumulácia a účinky hydroxidu metyl ortuti v terestrariálnom potravinovom reťazci v laboratórnych podmienkach. Prostredie. Znečistenie. (5) (1973) pp. 305-316. Zotavené z vedeckých pracovníkov.com.
- « Flavin Adenin Dinukleotid (FAD) Charakteristiky, biosyntéza
- Glyceraldehyd 3-fosfát (G3P) Štruktúra, funkcie »

