Štruktúra hydroxidu chrómu, vlastnosti, syntéza, použitie

- 1603
- 447
- Alfréd Blaho
On Chrómový hydroxid Je to anorganický zlúčenina produktu reakcie bázy s chrómovou soľou. Jeho chemický vzorec sa líši v závislosti od stavu oxidácie chrómu (+2 alebo +3 pre tento typ zlúčeniny). Teda CR (OH)2 Pre chrómový hydroxid (II) a CR (OH)3 Pre hydroxid chróm (III).
Z elektronických dôvodov CR2+ je nestabilnejší ako CR3+, Takže cr (oh)2 Je to redukčné činidlo (stráca elektrón na presun na +3). Teda, aj keď obidva hydroxidy možno získať ako zrazeniny, CR (OH)3 -Nazýva sa tiež chromický hydroxid- je prevládajúcou zlúčeninou.
 Vzhľad hydroxidu chrómu
Vzhľad hydroxidu chrómu Na rozdiel od hydroxidov získaných jednoduchým rozpustením oxidov kovov vo vode, CR (OH)3 Touto cestou nie je syntetizovaná kvôli zlej rozpustnosti chromického oxidu (CR2Ani3, horný obrázok). Avšak CR (OH)3 Považuje sa za CR2Ani3· Xh2Alebo sa používa ako smaragdový zelený pigment (Guinet Green).
V laboratóriu je založený na kovovom chróme, ktorý sa rozpustí v kyslom roztoku na tvorbu komplexu [Cr (OH2)6]3+. Tento vodný komplex potom reaguje so bázou (NaOH alebo KOH) za vzniku zodpovedajúceho chromického hydroxidu.
Ak sa predchádzajúce kroky vykonávajú za podmienok, ktoré zabezpečujú neprítomnosť kyslíka, reakcia pochádza z CR (OH)2 (Chrómový hydroxid). Následne sa vyžaduje separácia a dehydratácia tuhej látky zrazeniny. Výsledkom je, že skutočný CR (OH) je „narodený“3, Zelený prášok s polymérnou a neistou štruktúrou.
[TOC]
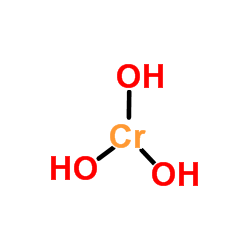
Štruktúra hydroxidu chrómu
Horný obrázok je najjednoduchšou reprezentáciou CR (OH)3 v plyne a izolovanej fáze. Tiež a predpokladanie čisto iónového charakteru jeho interakcií, v tuhých katiónoch je možné vizualizovať3+ Interakcia s trojitým množstvom OH aniónov-.
Môže vám slúžiť: molárne absorbovaniePovaha spojenia CR-OH je však kovalentnejšia v dôsledku koordinačnej chémie CR3+.
Napríklad komplex [cr (OH2)6]3+ Znamená to, že kovové chrómové centrum je koordinované so šiestimi molekulami vody; Pretože sú neutrálne, komplex vykazuje pozitívne zaťaženie pôvodného katiónu, Cr3+.
Oktadron a polymerizácia
Na hornom obrázku štruktúra komplexu [CR (OH je zastúpená2)6]3+. Ióny- Môžu pochádzať napríklad z kyseliny chlorovodíkovej v prípade, že sa použila na rozpustenie soli alebo chromického oxidu.
Keď sa do reakčného média pridá NaOH (alebo KOH), OH ión- Uns a molekula tohto komplexu, ktorá sa vytvára [cr (OH2)5(Oh)]2+ (Teraz je k dispozícii päť molekúl vody, pretože šiesta stratila protón).
Tento nový dehydrátový komplex v inom vodnom komplexe, ktorý vytvára Dímeros United pomocou hydroxidových mostov:
(H2Buď)5Cr-oh-cr (oh2)5
Ako sa zvyšuje zásaditosť média (pH stúpa) komplex [cr (OH2)4(Oh)2]+, a tiež zvyšujte pravdepodobnosť nových mostov hydroxidu, aby sa vytvorili želé -polyméry. V skutočnosti táto „šedo zelená želé“ odmieta urýchliť usporiadanie.
Nakoniec, cr (oh2)3(Oh)3 Pozostáva z oktadronu s CR3+ V strede a spojený s tromi molekulami vody a tromi oh- To neutralizuje ich pozitívny náboj; To bez zváženia polymerizácie.
Keď CR (Oh2)3(Oh)3 Je dehydratovaná, koordinovaná voda s CR je eliminovaná3+, A keďže táto katión je koordinovaný so šiestimi druhmi (ligandy), vznikajú polymérne štruktúry, v ktorých sú zapojené spojenia CR-CR.
Môže vám slúžiť: Butyrický tuk: získanie, typy, zloženie, použitia, výhodyKeď je dehydratácia, môže sa jej štruktúra považovať za typ CR2Ani3· 3H2Buď; Inými slovami, trikhydratovaný chrómový oxid. Sú to však fyzikálno -chemické štúdie tuhej látky, ktoré môžu objasniť skutočnú štruktúru CR (OH)3 v tomto bode.
Fyzikálne a chemické vlastnosti hydroxidu chrómu
CR (OH)3 Vyzerá to ako modro-zelený prášok, ale keď príde do kontaktu s vodou, tvorí šeditá zelená želé.
Je nerozpustný vo vode, ale rozpustný v kyselinách a silných základoch. Okrem toho, keď sa zahrieva, rozpadá sa a produkuje výpary oxidu chrómového oxidu.
Anfoterizmus
Prečo je hydroxid chróm rozpustný v kyslých a základných roztokoch? Dôvod je z dôvodu jeho znaku amfoter, ktorý vám umožňuje reagovať s kyselinami aj základňami. Táto vlastnosť je charakteristická pre Cr3+.
Pri reagovaní s kyselinami, CR (OH2)3(Oh)3 Je rozpustená, pretože hydroxylové mosty sú zlomené a zodpovedné za želé precipitátu.
Na druhej strane, keď sa pridá viac základne, OH- Naďalej nahradia molekuly vody a tvoria negatívny komplex [cr (OH2)2(Oh)4]-. Tento komplex premení roztok svetlozelenej farby, ktorá sa zintenzívňuje, keď reakcia pokračuje.
Keď všetky Cr (Oh2)3(Oh)3 Reagovali ste, jeden posledný komplex sa získa, ako je naznačené chemickou rovnicou:
Cr (Oh2)3(Oh)3 + 3 oh- [Cr (OH)6] 3- + 3 h2Ani
Tento negatívny komplex je spojený s okolitými katiónmi (NA+, Ak je základ NaOH) a po odparovaní vody, soľ chromito sodného (Nacro2, smaragdová zelená farba). Teda kyslé aj základné médium sú schopné rozpustiť hydroxid chrómu.
Môže vám slúžiť: IndSyntéza hydroxidu chrómu v priemyselnej oblasti
V priemysle sa vyrába zrážaním sulfátu chrómom s roztokmi hydroxidu sodíka alebo hydroxidu. Podobne sa hydroxid chrómu vyrába schematizovanou reakciou:
Croch72- + 3 SO2 + 2h+ => 2 cr3+ + 3 SO42- + H2Ani
Cr3+ + 3OH- => Cr (OH)3
Ako je uvedené v predchádzajúcom postupe, redukcia chrómu VI na Chrome III má veľký ekologický význam.
Chróm III je relatívne neškodný pre biotu, zatiaľ čo chróm VI je toxický a karcinogénny, okrem veľmi rozpustných, takže jeho eliminácia životného prostredia je dôležité.
Technológia úpravy vody a pôdy zahŕňa zníženie z CR (VI) na CR (III).
Žiadosti
Hydroxid chrómu má rôzne aplikácie:
- Formulácia make -upu.
- Farbivá na vlasy.
- Lak na nechty.
- Produkty starostlivosti o pleť.
- Čistiace produkty.
- V kovovej povrchu, ktorá predstavuje 73 % svojej spotreby v priemysle.
- Pri uchovávaní dreva.
Odkazy
- Whitten, Davis, Peck & Stanley. Chémia. (8. vydanie.). Cengage Learning, s. 873, 874.
- Publikácia. Chromický hydroxid. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda
- Syntéza, charakterizácia a stabilita hydroxidov CR (III) a Fe (III). Papassiopi, n., Vaxevanidou, K., Christou, c., Karagianni, e. a antipas, g. J. Nebezpečenstvo. 264: 490-497.
- Prebchem. Príprava hydroxidu chrómu (III). Získané z prepchemu.com
- Wikipedia. (2018). Chrómový hydroxid. Získaný z.Wikipedia.orgán