Štruktúra hydroxidu hliníka, vlastnosti, použitie, riziká
- 2121
- 567
- Gabriel Bahna
On hydroxid hliníka Je to anorganická zlúčenina, ktorej chemický vzorec je v (OH)3. Na rozdiel od iných kovových hydroxidov je to amfotero, ktoré je schopné reagovať alebo sa správať ako kyselina alebo báza, v závislosti od média. Je to celkom nerozpustná biela tuhá látka vo vode, takže sa používa ako súčasť antacidových látok.
Ako mg (oh)2 alebo brucita, s ktorou zdieľa určité chemické a fyzikálne vlastnosti, čisto vyzerá ako amorfná a lesková pevná; Ale keď kryštalizuje s určitými nečistosťami, získa kryštalické formy, akoby to boli perly. Medzi týmito minerálmi, prírodné zdroje Al (OH)3, je gibbsita.
 Špeciálny kryštál Gibbsita. Zdroj: Rob Lavinsky, Irocks.com-ccy-SA-3.0 [CC By-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]
Špeciálny kryštál Gibbsita. Zdroj: Rob Lavinsky, Irocks.com-ccy-SA-3.0 [CC By-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Okrem gibbsitu sú tiež minerály Bayerite, Nordstrandite a Doley, ktoré tvoria štyri polymorfy hydroxidu hliníka. Štrukturálne sú veľmi podobné navzájom, diferencujú sa navzájom tak, ako sa nachádzajú alebo spájajú vrstvy alebo ióny.
Ovládanie parametrov pH a syntézy je možné pripraviť ktorýkoľvek z týchto polymorfov. Podobne môžu byť medzi ich vrstvami rozptýlené niektoré záujmové druhy chemických látok, takže sa vytvárajú materiály alebo zlúčeniny rozptýlených. To predstavuje použitie viac technologického prístupu k AL (OH)3. Jeho ďalšie použitia sú ako antacidy.
Na druhej strane sa používa ako surovina na získanie hlinitého a jeho nanočastice sa použili ako katalytická podpora.
[TOC]
Štruktúra
Vzorec a oktaedro
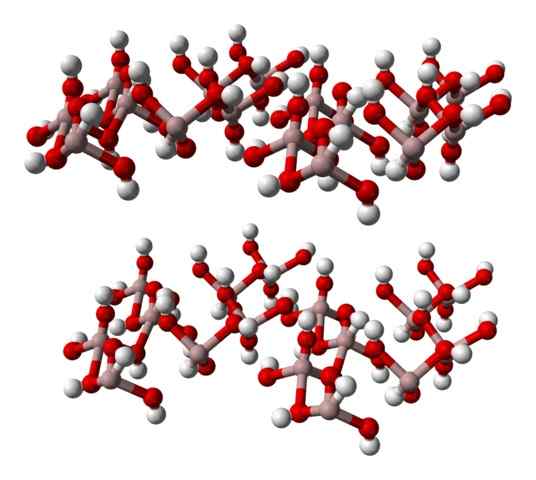
Chemický vzorec v (OH)3 naznačuje, že akonáhle je vzťah k3+: Oh- Je to 1: 3; to znamená, že existujú tri anióny Oh- za každú katión do3+, čo je rovnaké ako tvrdenie, že tretia časť jeho iónov zodpovedá hliníku. Takže Al3+ a oh- Interagujú elektrostaticky, až kým ich atrakcie-repulzie definujú šesťuholníkový kryštál.
Avšak al3+ Nie je to nevyhnutne obklopené tromi ach- Ale šesť; Preto sa hovorí o koordinácii oktadronu v (oh)6, v ktorých existuje šesť interakcií al-o. Každý oktaedron predstavuje jednotku, s ktorou je sklo postavené, a mnohé z nich prijímajú trilinické alebo monoklinické štruktúry.
Dolný obrázok čiastočne predstavuje oktaedru (oh)6, Pretože sú pozorované iba štyri interakcie3+ (svetlo hnedé gule).
 Gibbsite Hexagonal Glass, minerál hydroxidu hliníka. Zdroj: Benjah-Bmm27 [verejná doména].
Gibbsite Hexagonal Glass, minerál hydroxidu hliníka. Zdroj: Benjah-Bmm27 [verejná doména]. Ak je táto štruktúra starostlivo pozorovaná, čo zodpovedá štruktúre minerálu Gibbsite, možno uvažovať o tom, že biele gule integrujú „tváre“ alebo povrchy iónových vrstiev; To sú, atómy vodíka OH iónov-.
Môže vám slúžiť: Prenajmite si halogenuros: vlastnosti, získanie, príkladyVšimnite si, že existuje vrstva A a iná B (priestorovo nie sú identické), spolu navzájom vodíkovými mostmi.
Polymorfy
Vrstvy A a B nie sú vždy spojené rovnakým spôsobom, ako aj ich fyzické prostredie alebo ióny hostí (soli) sa môžu zmeniť. V dôsledku toho kryštály Al (OH)3 Líšia sa v štyroch mineralogických formách alebo v tomto prípade polymorfné.
Potom sa hovorí, že hydroxid hlinitý má až štyri polymorfy: gibbsit alebo hydragilit (monoklinický), Bayerit (monoklinický), doyleíta (tricyklovanie) a nordstrandit (trichlinický). Z týchto polymorfov je Gibbsita najstabilnejšia a najhojnejšia; Ostatné sú klasifikované ako vzácne minerály.
Keby boli kryštály pozorované na mikroskope, bolo by zrejmé, že ich geometria je šesťuholníka (hoci trochu nepravidelná). PH hrá dôležitú úlohu pri raste takýchto kryštálov a výslednej štruktúry; to znamená, vzhľadom na pH polymorf alebo iný sa môže tvoriť.
Napríklad, ak médium, kde sa Al (OH) zráža3 Má pH menšie ako 5,8 gibbsita; Aj keď je pH väčšie ako táto hodnota, vytvorí sa Bayerita.
Vo viacerých základných médiách majú tendenciu tvoriť kryštály Nordstrandita a Doyleíta. Takže, keďže som najhojnejší gibbsite, je to skutočnosť, ktorá odráža kyslosť jeho zvetrávania prostredí.
Vlastnosti
Fyzický vzhľad
Biela pevná látka, ktorá môže prísť v rôznych formátoch: granulovaný alebo prášok a amorfný vzhľad.
Molárna hmota
78.00 g/mol
Hustota
2,42 g/ml
Bod topenia
300 ° C. Nemá žiadny bod varu, pretože hydroxid stráca vodu, aby sa transformoval na hlinitého alebo oxid hlinitý2Ani3.
Rozpustnosť
1 · 10-4 G/100 ml. Jeho rozpustnosť sa však zvyšuje s pridaním kyselín (H3Ani+) alebo alkalis (oh-).
Produkt rozpustnosti
Klimatizovaťspona = 3 · 10-34
Táto malá hodnota znamená, že iba malá časť sa rozpúšťa vo vode:
Al (oh)3(soľ3+(Ac) +3OH-(Ac)
A v skutočnosti táto opovrhnutiahodná rozpustnosť z neho robí dobrú neutralizátor kyslosti, pretože príliš nezačína žalúdočné prostredie na to, aby neuvoľnila takmer ióny, oh-.
Anfoterizmus
Al (Oh)3 Vyznačuje sa jej amfoterovým charakterom; to znamená, že môže reagovať alebo sa správať, akoby to bola kyselina alebo báza.
Napríklad reagujte s H iónmi3Ani+ (Ak je médium vodné) za vzniku komplexného acuo [do (OH2)6]3+; ktorý je zase hydrolyzovaný na okyslenie životného prostredia, preto Al3+ Kyslý ión:
Môže vám slúžiť: Cannizzaro Reakcia: Charakteristiky, mechanizmy, príkladyAl (oh)3(s) +3h3Ani+(ac) => [al (OH2)6]3+(Ac)
[Al (Oh2)6]3+(Ac) +h2Alebo (l) [al (oh2)5(Oh)]2+(Ac)+h3Ani+(Ac)
Keď sa to stane, hovorí sa, že Al (OH)3 Správa sa ako základňa, pretože reaguje s H3Ani+. Na druhej strane môžete reagovať s OH-, Správanie sa ako kyselina:
Al (oh)3(s) +oh-(ac) => ah (oh)4-(Ac)
V tejto reakcii biela zrazenina Al (OH)3 Rozpúšťa sa s nadbytkom iónov ach-; Skutočnosť, že sa nestane rovnaká s inými hydroxidmi, ako je horčík, mg (OH)2.
Al (Oh)4-, hlinitý ión, možno ho vyjadriť vhodnejšie ako: [al (OH2)2(Oh)4]-, zvýraznenie koordinačného počtu 6 pre katión až3+ (Octaedro).
Tento ión môže pokračovať v reagovaní s viac OH- Až do koordinácie oktadron: [Al (OH)6]3-, nazývaný hexahidroxoaluminát ión.
Menovanie
Názov „hydroxid hlinitý“, ktorý sa najviac zmienil o tejto zlúčenine, zodpovedá vládnutiu nomenklatúry zásob. (Iii) sa vynechá na konci, pretože stav oxidácie hliníka je +3 vo všetkých jeho zlúčeninách.
Ďalšie dve možné mená sa odvolávajú na Al (OH)3 Sú to: hliníkový trihydroxid, podľa systematickej nomenklatúry a použitia gréckych čitateľov; a hliníkový hydroxid, končiace príponou -ICO pre mať jediný oxidačný stav.
Aj keď v chemickej oblasti nomenklatúra Al (OH)3 Nepredstavuje žiadnu výzvu ani zmätok, mimo neho má tendenciu sa zmiešať s nejasnosťami.
Napríklad minerál Gibbsita je jedným z prírodných polymorfov Al (OH)3, na ktoré tiež pomenujú ako y-al (OH)3 alebo a-al (OH)3. Avšak a-al (OH)3 Môže tiež zodpovedať minerálu Bayerita alebo p-al (OH)3, Podľa kryštalografickej nomenklatúry. Medzitým sa polymorfy Nordstrandita a Doyleita zvyčajne označujú ako (OH)3.
Nasledujúci zoznam jasne sumarizuje novo vysvetlené:
-Gibbsita: (γ alebo a) -al (OH)3
-Bayerita: (a alebo β) -Al (OH)3
-Nordstrandita: AL (OH)3
-Doyleita: al (oh)3
Žiadosti
Surový materiál
Okamžité použitie pre hydroxid hlinitý je surovina na výrobu hlinitého alebo iných zlúčenín, anorganických alebo organických hliníkov; Napríklad: Alcl3, Nie3)3, ALF3 alebo naal (oh)4.
Katalyzácia
AL (OH) nanočastice3 Môžu pôsobiť ako katalytické podpory; to znamená, že katalyzátor sa k nim spája, aby sa pripevnil na ich povrch, kde sa chemické reakcie zrýchľujú.
Môže vám slúžiť: Syntéza reakcie: typy, faktory, príkladyMedzinárodné zlúčeniny
V sekcii štruktúry bolo vysvetlené, že Al (OH)3 Skladá sa z vrstiev alebo listov A a B, spojené s definovaním kryštálu. V ňom sú malé oktaedrálne priestory alebo dutiny, ktoré môžu byť obsadené inými iónmi, kovovými alebo organickými alebo neutrálnymi molekulami.
Keď sú kryštály syntetizované z (OH)3 Pri týchto štrukturálnych modifikáciách sa hovorí, že sa pripravuje zlúčenina interkalácie; to znamená, že je rozptýlený alebo dajte chemické druhy medzi listy A a B. Pritom vznikajú nové materiály vyrobené z tohto hydroxidu.
Spomaľovač horenia
Al (Oh)3 Je to dobrý spomaľovač horenia, ktorý zistí, že aplikácia ako náplňový materiál mnohých polymérnych matíc. Je to preto, že absorbuje teplo na uvoľňovanie vodnej pary, ako to robí Mg (OH)2 alebo Brucita.
Liečivý
Al (Oh)3 Je to tiež neutralizujúca kyslosť, ktorá reaguje s HCl sekrécií žalúdka; Opäť, podobne ako to, ako sa to deje s MG (OH)2 magnézie mlieka.
Oba hydroxidy sa môžu zmiešať v rôznych antacidách, ktoré sa používajú na zmiernenie príznakov ľudí trpiacich gastritídou alebo žalúdočnými vredmi.
Adsorbent
Keď sa zahrieva pod jeho topením, hydroxid hlinitý sa transformuje na aktivovaný hliník (ako aj na aktívny uhlie). Táto tuhá látka sa používa ako adsorbent nežiaducich molekúl, buď farbivá, nečistoty alebo znečisťujúce plyny.
Riziká
Riziká, ktoré môžu predstavovať hydroxid hlinitý, nie sú spôsobené tým ako solídne, ale ako liek. Na jeho uloženie nie je potrebný žiadny protokol alebo nariadenia.
Pri požití v antacidách, ktoré sa dosahujú v lekárňach, sa môžu objaviť nežiaduce vedľajšie účinky, ako je zápcha a inhibícia fosfátu čreva. Tiež, aj keď neexistujú žiadne štúdie, ktoré by to demonštrovali, je spojená s neurologickými poruchami, ako je napríklad Alzheimerova choroba.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Wikipedia. (2019). Hliník. Zdroj: In.Wikipedia.orgán
- Národné centrum pre biotechnologické informácie. (2019). Hliník. Databáza pubchem. CID = 10176082. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Danielle Reid. (2019). Hliník hydroxidu: vzorec a vedľajšie účinky. Štúdium. Získané z: štúdie.com
- Robert Schoen a Charles a. Roberson. (1970). Štruktúry hydroxidu hliníka a geochemických dôsledkov. Americký mineralog, zv. 55.
- Vitaly P. Isupov & Col. (2000). Syntéza, štruktúra, vlastnosti a aplikácia interkalačných zlúčenín hydroxidu hlinitého. Chémia pre trvalo udržateľný rozvoj 8,121-127.
- Drogy. (24. marca 2019). Hliníkový hydroxid vedľajšie účinky. Získané z: drog.com
- « Vanadio História, vlastnosti, štruktúra, použitie
- História niklu, vlastnosti, štruktúra, použitie, riziká »

