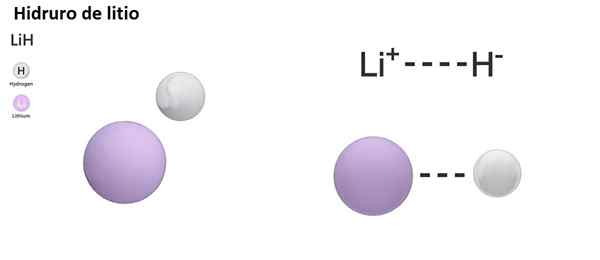Hydrors
- 2402
- 0
- Gabriel Bahna
Čo sú hydruros?
Hydros sú chemické zlúčeniny, ktoré sú výsledkom reakcie vodíka s kovovými prvkami (sodík, draslík, vápnik atď.) a nie kovy (chlór, fluór, kyslík, dusík, uhlík atď.). Vodík reaguje takmer so všetkými chemickými prvkami, takže hydrory sú veľmi rozmanité látky.
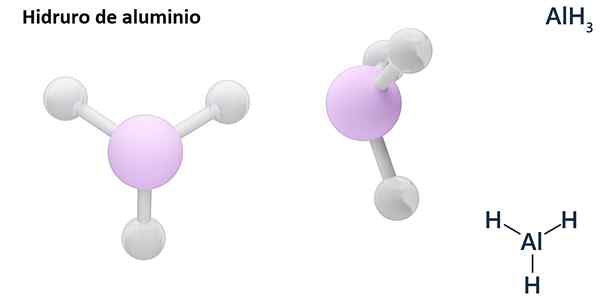
Jeho všeobecné vzorce môžu byť typ MHn, Kde m je kov a n jej Valencia (+1, +2, +3), ako je hydrid hliníka, alh3; alebo typu EHn alebo hnA kde E je nemetalický prvok a n Jej Valencia, ako NH3 alebo h2Siež.
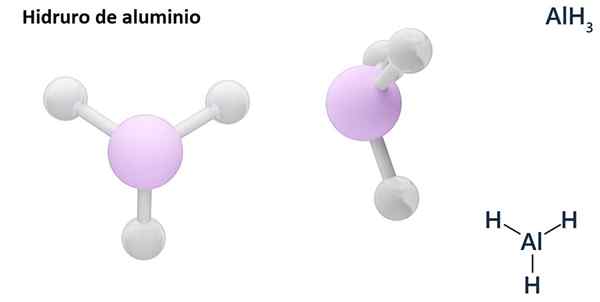
Hydros sú zvyčajne binárne zlúčeniny, to znamená, že sú výsledkom kombinácie vodíka s iným chemickým prvkom. Vodík však môže tiež stanoviť kombinácie s niekoľkými chemickými prvkami, aby sa vytvorili zložitejšie hydrory. Všetky vysvetlené hydrory budú binárne, napríklad AlH3 a nie.
Existujú tri typy hydrorov podľa povahy jej chemickej väzby: iónová, molekulárna a kovová. Iónové alebo soľné hydrory sa vyznačujú prítomnosťou iónovej väzby. Toto spojenie pozostáva z elektrickej príťažlivosti medzi kladným zaťažením alkalického kovu (NA+) alebo alkalické puto (mg2+) a záporné zaťaženie hydridového aniónu (h-).
Molekulárne hydridy sa na druhej strane vyznačujú tvorbou kovalentnej väzby medzi vodíkom a nemetalickým prvkom. Medzi nemetalické prvky, ktoré tvoria hydros, patria: chlór, bróm, fluór, jód, kyslík a dusík.
A kovové hydrory sú výsledkom kombinácie vodíka s niektorými prechodnými kovmi. Tento typ hydridov, na rozdiel od predchádzajúcich, má zložité štruktúry a tu sa nebude vysvetliť tu.
Vlastnosti hydros
Vlastnosti hydrén sa líšia v závislosti od typu hydridu: iónové, molekulárne alebo kovové, takže ich vlastnosti musia byť označené osobitne.
Iónové alebo soľné hydrory
Sú to kryštalické biele tuhé látky, ale kvôli prítomnosti nečistôt získavajú šedivú farbu. Tieto hydridy nie sú rozpustné v bežných rozpúšťadlách, ako je voda, alkohol atď. Majú tiež vysoké vary a fúzne body.
Majú vysokú a roztavenú hustotu stavu môže viesť elektrinu.
Iónové hydurns sa považujú za základné alebo alkalické, pretože rozpustené vo vode tvoria hydroxidy a uvoľňujú molekulárny vodík:
Nah +h2O → h2 + Naoh
Reakcia iónového hydridu s vodou je veľmi energická a nebezpečná: produkuje vodík v plynnej forme, čo je horľavý a horľavý materiál.
Iónové hydurns môžu tiež reagovať s halogenidami kovov, tvorené kovom a ne -metal známym ako halogén (MX, X = F, Cl, Br, I):
Môže vám slúžiť: dimetylanylín: štruktúra, vlastnosti, syntéza, použitie4 LIH +ALCL3 → Liah4 + 3 licl
LIH (lítium hydrid) je binárna zlúčenina; zatiaľ čo Liah4 (Lítium a hydrid hliníka) je ternárna zlúčenina, to znamená, že pozostáva z troch chemických prvkov.
Molekulárny alebo kovalentný hydros
Sú v kvapalnom alebo plynnom stave na rozdiel od iónových hydrorov, ktoré sú pevné. Majú nízke varné a fúzne body, ktoré pozorujú, že zvýšením molekulovej hmotnosti hydridu sa zvyšuje bod varu; s výnimkou amoniaku (NH3), Voda (h2O) a hydrid fluorid (HF).
Kovalentné hydridy sú zlé vodiče elektriny a mnohé z ich vlastností sú spôsobené tvorbou vodíkových mostov. Kovalentné hydridy sa považujú za kyseliny, pretože rozpustené vo vode môžu spôsobiť kyseliny, napríklad kyselinu chlorovodíkovú.
Kovové hydrory
Sú v tuhom stave a prezentujú tmavý tón kovov. Sú to dobré elektrické vodiče a majú lesklé povrchy. Kovové hydridy, ktoré sú stabilné vo vzduchu, sa stávajú činidlami, keď sa zahrievajú, napríklad hydrid urán (UH3) Predstavte túto vlastnosť.
Menovanie
Spôsob, ako pomenovať Hydrors, je jednoduchý a v žiadnej z nomenklatúry sa príliš nemení. Ak má metalický kov alebo prvok viac ako jednu valenciu, je špecifikovaný v zátvorkách a s rímskym číslom podľa akciovej nomenklatúry.
Napríklad feh3 sa nazýva hydrid železa (III) a COH2 Cobalt Hydro (II). Rovnaké hydridy môžu byť vymenované aj pomocou systematickej nomenklatúry, ktorá využíva grécke čísla (Di, Tri, Tetra atď.). Tak, feh3 sa nazýva železná trihydrid a coh2 kobalt dihydruro.
Klasická nomenklatúra sa pre hydros nepoužíva široko. Napríklad NAH je známa skôr ako hydrid sodný a nie hydrid sodný.
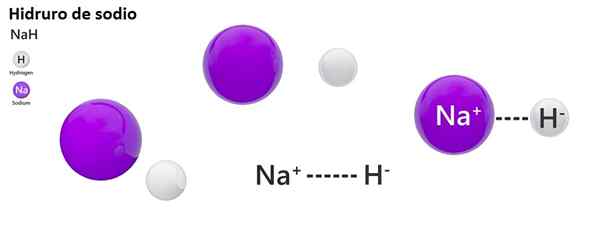 Hydrid sodný
Hydrid sodný Ako sa tvoria hydros?
Iónové alebo soľné hydrory
Tvoria sa reakciou vodíka s kovom patriacim do skupiny alkalických kovov alebo skupinou alkalických kovov.
V hydroroch trénovaných s týmito kovmi sa vodík nachádza vo forme H-, známy ako anión hydridu.
Alkalické kovy (lítium, sodík, draslík, rubidium a cézium) reagujú s vodíkom za vzniku ich zodpovedajúcich hydurnov:
2 m (l)+h2g) → 2MH (s)
Môže vám slúžiť: jednotkové operácieKov M, keď je reagovanie v kvapalnom stave a vodík v plynnom stave, takže reakcia vyžaduje vysoké teploty a vysoké tlaky. Zvážte nasledujúci príklad:
2 li (l) +h2 g) → 2 lih (s)
Reakcia vodíka s alkalickými tretinami kovov (berylia, horčík, vápnik, stroncium a bária) na tvorbu hydrid.
Horčík a berylium tvoria hydridy, ale ich väzby s vodíkom sú kovalentného typu; To je, ne -ionické, na rozdiel od iných alkalických kovov:
Ca (l) +h2 g) → CAH2 (S)
Molekulárne hydrory
Vodík môže reagovať s nemetalmi, ktoré zodpovedajú skupinám 14, 15, 16 a 17 periodickej tabuľky, aby vytvorili molekulárne hydrory. Zoberme si napríklad tvorbu hydridu fluoridu kombináciou alebo priamou zmesou vodíka s fluórom:
H2 g) +f2 (G) → 2 HF (G)
HF je známy skôr ako fluorid vodíka, ale nazýva sa tiež fluorid hydrid.
Vodík tiež môže reagovať s kyslíkom (skupina 16 periodickej tabuľky) podľa tej istej schémy:
2 h2 g) +alebo2 g) → 2 h2O (g)
Reakcia vyžaduje tepelný prívod na výrobu oxidu vodíka (voda) alebo hydrid kyslíka.
Vodík môže tiež reagovať s dusíkom, ktorý patrí do skupiny 15 periodickej tabuľky za vzniku hydrid dusíka, lepšie známy ako amoniak (NH3).
N2 g) +3 h2 g) → 2 NH3 g)
Reakcia vyžaduje prívod tepla, vysoký tlak a prítomnosť katalyzátorov (urýchľujú chemické reakcie).
Kovové hydrory
Sú tvorené reakciou prechodných kovov (skupiny 3, 4, 5, 6, 10, 11 a 12 periodickej tabuľky) s vodíkom. Prechodné kovy skupín 7, 8 a 9 však nevytvárajú zlúčeniny s vodíkom, jav známy ako hydridová medzera alebo hydrid medzery.
Unikátna charakteristika hydrorov prechodných kovov je to, že nie vždy predstavujú pevný podiel medzi počtom atómov vodíka a počtom atómov prítomných v hydridu. To znamená, že ich vzorce a štruktúry nie sú jednoduché reprezentovať.
Použitie/aplikácie Hydros
 Hydros sú veľmi prítomné v jednom z mnohých typov batérií: ako NIMH. Zdroj: Multicherry, CC BY-SA 4.0, cez Wikimedia Commons
Hydros sú veľmi prítomné v jednom z mnohých typov batérií: ako NIMH. Zdroj: Multicherry, CC BY-SA 4.0, cez Wikimedia Commons Hydros sú prítomné v niklových kovových hydridových batériách (NIMH), ktoré sa používajú spoločne so vzácnymi kovmi Zeme, kobaltom alebo mangánom. Bolo skúmaných niekoľko kovových hydrorov na použitie v elektrických automobiloch poháňaných bunkami súvisiacimi s vodíkmi.
Môže vám slúžiť: Metóda redoxnej rovnováhy: kroky, príklady, cvičeniaRedukcia agentov
Hydrid lítium a bór sodný (NABH4) Sa používajú ako chemické reakcie v reakciách organických syntéz.
Skladovanie vodíka a ďalšie súvisiace použitia
Existujú piloti používania vodíka ako paliva v motorových vozidlách, ale vďaka svojej výbušnosti bolo jeho použitie obmedzené ako palivo. Použitie hydrosu bolo navrhnuté ako forma skladovania vodíka, aby sa tak kontrolovalo ich nebezpečenstvo.
Okrem toho sa hydrory použili na čistenie a separáciu senzorov vodíka a teploty.
Zjazdovky
Hydrid vápenatý sa používa na odstránenie vody prítomnej v organických rozpúšťadlách.
Kyseliny vznikli s molekulárnymi hydrormi
Napríklad: Kyselina chlorovodíková sa tvorí roztokom vo vodnom médiu hydridu chlóru (HCL), pričom pri eliminácii oxidov, ktoré pokrývajú železo, a okyslenie ropných jamiek, produkcia chloridu vápnika a minerálového ošetrenia, acidifikácie ropných vrtov, produkcia chloridu.
Hnojivo
Amoniak (NH3) Je to hydrid, ktorý sa používa ako kvapalné hnojivo a slúži na syntézu zlúčenín s dusičnanom amónny a síranu amónneho, ktoré sa používajú ako hnojivá.
Vodná voda
Je najdôležitejšia hydrid. Používa sa v mnohých odvetviach s rôznymi použitiami a aplikáciami. Voda je hlavným zodpovedným za existenciu živých bytostí.
Príklady hydrorov
Nakoniec budú uvedené ďalšie príklady hydrorov s ich príslušnými vzorcami a menámi:
SNH4: Tin hydrid | PH3: hydrid fosfor (fosfín) alebo trihydrid fosforu |
KH: Hydrid olovo | MGH2: Hydridy horčík alebo horčík dihydruro |
KH: Hydrid draslíka | CH4: Carruro Carruro alebo uhlíkový tetrahydrid (metán) |
CAH2: hydrid vápenatý | FEH2: Hydrid železa (II) |
NAH: Hydrid sodný | Znh2: Hydrid zinku |
LIH: Lítium Hydrid | BAH2: Hydrid bária |
CSH: Hydrid cesium | BH3: Boron Hydro (Bas |
Beh2: Beryl alebo Beryl Dihydrid Hydrid | Sih4: Silicon Hydro (Silan) |
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Wojes, Ryan. (27. augusta 2020). Čo je kovový hydrid? Zotavené z: Thoughtco.com
- Americké prvky. (2020). Hydrididy. Zdroj: Američania.com
- Wikipedia. (2020). Hydrid. Zdroj: In.Wikipedia.orgán
- Tamandis arani. (15. augusta 2020). Hydrididy. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- Redaktori Enyclopaedia Britannica. (2020). Hydrid. Získané z: Britannica.com