Štruktúra hydrolasázy, funkcie, príklady

- 789
- 70
- Valentín Dula
Ten Hydroláza Sú to enzýmy, ktoré sú zodpovedné za hydrolyzovanie rôznych typov chemických väzieb v mnohých rôznych zlúčeninách. Medzi hlavné spojenia, ktoré Hydrolyz patria esterové, glukozidné a peptidové väzby.
V skupine hydroláz bolo klasifikovaných viac ako 200 rôznych enzýmov, zoskupených najmenej 13 jednotlivých súborov; Jeho klasifikácia je v podstate založená na type chemickej zlúčeniny, ktorá slúži ako substrát.
 Grafické modelovanie s bioinformatickými nástrojmi štruktúry hydrolázy (zdroj: Jawahar Swaminathan a personál MSD v Európskom bioinformatickom inštitúte [verejná doména] prostredníctvom Wikimedia Commons) prostredníctvom Wikimedia Commons)
Grafické modelovanie s bioinformatickými nástrojmi štruktúry hydrolázy (zdroj: Jawahar Swaminathan a personál MSD v Európskom bioinformatickom inštitúte [verejná doména] prostredníctvom Wikimedia Commons) prostredníctvom Wikimedia Commons) Hydrolázy sú nevyhnutné pre trávenie potravín v čreve zvierat, pretože sú zodpovedné za degradovanie veľkej časti spojení, ktoré tvoria sýtené štruktúry potravín, ktoré požívajú.
Tieto enzýmy fungujú vo vodnom médiu, pretože potrebujú okolo nich molekuly vody, aby sa pri rozdelení molekúl pridali do zlúčenín. Jednoducho povedané, hydrolázy vykonávajú hydrolytickú katalýzu zlúčenín, na ktorých pôsobia.
Napríklad, keď hydroláza prelomí kovalentnú väzbu C-C, výsledkom je zvyčajne skupina C-O a skupina C-H.
[TOC]
Štruktúra
Rovnako ako mnoho enzýmov, aj hydrolázy sú organizované globulárne proteíny v komplexných štruktúrach, ktoré sú organizované prostredníctvom intramolekulárnych interakcií.
Hydrolázy, rovnako ako všetky enzýmy, sa viažu na jednu alebo viac molekúl substrátu v oblasti jej štruktúry, ktorá je známa ako „aktívne miesto“. Táto stránka je vrecko alebo rozštep obklopený mnohými aminokyselinovými zvyškami, ktoré uľahčujú priľnavosť alebo spojenie substrátu.
Každý typ hydrolázy je špecifický pre daný substrát, ktorý je určený jeho terciárnou štruktúrou a tvorbou aminokyselín, ktoré vytvárajú ich aktívne miesto. Emil Fischer vzniesol túto špecifickosť didakticky ako druh „kľúč a zámku“.
Môže vám slúžiť: polymeráza: charakteristiky, štruktúra a funkcieV súčasnosti je známe, že substrát vo všeobecnosti indukuje zmeny alebo skreslenie pri tvorbe enzýmov a že enzýmy zase skresľujú štruktúru substrátu, aby sa zabezpečilo, že táto „čipka“ v jeho aktívnom mieste.
Funkcia
Všetky hydrolázy majú hlavnú funkciu lámania chemických väzieb medzi dvoma zlúčeninami alebo v rámci štruktúry tej istej molekuly.
Existujú hydrolázy na prelomenie takmer akéhokoľvek typu spojenia: niektoré degradujú esterové väzby medzi uhľohydrátmi, iné peptidové väzby medzi proteínovými aminokyselinami, iné karboxylové väzby atď.
Účel procesu chemickej väzby katalyzovaný hydrolázovým enzýmom sa značne líši. Napríklad SmoZým je zodpovedný za hydrolýzu chemických väzieb s účelmi ochrany organizmu, ktoré ho syntetizujú.
Tento enzým degraduje spojenia, ktoré sa držia spolu so zlúčeninami v bunkovej stene baktérií, s cieľom chrániť ľudské telo pred bakteriálnou proliferáciou a možnou infekciou.
Nukleas sú enzýmy „fosfatázy“, ktoré majú schopnosť degradovať nukleové kyseliny, ktoré môžu tiež predstavovať mechanizmus obrany buniek proti vírusom DNA alebo RNA.
Ostatné hydrolázy, ako sú napríklad typy „proteáz“, degradujú peptidové väzby proteínov v tráviacich traktoch, aby sa aminokyseliny stali asimilovateľnými v gastrointestinálnom epiteli.
Dokonca aj hydrolázy sa podieľajú na rôznych udalostiach výroby energie v bunkovom metabolizme, pretože fosfatázy katalyzujú uvoľňovanie fosfátových molekúl z vysoko energetických substrátov, ako je pyruvát, pri glykolýze.
Môže vám slúžiť: sójová priľnavosťPríklady hydrolasáz
Medzi veľkú rozmanitosť hydroláz, ktoré vedci identifikovali, niektorí boli študované s väčším dôrazom ako ostatní, pretože sa podieľajú na mnohých základných procesoch pre život bunky.
Medzi nimi patrí plynulosť, proteázový serín, endonukleózna a glukozidáza alebo glykozyraeózne fosfatázy.
Plynulosť
Enzýmy tohto typu prerušenie. To zvyčajne nakoniec spôsobuje celkovú lýzu baktérií.
Smozýmy bránia telo zvierat bakteriálnych infekcií a sú bohaté na sekrécie tela v tkanivách, ktoré sú v kontakte s prostredím, ako sú napríklad slzy, sliny a sliznice.
Hladké kuracie vajíčko bolo prvou proteínovou štruktúrou, ktorá kryštalizovala cez X -Rays. Túto kryštalizáciu vytvorila David Phillips v roku 1965 v London Real Institute.
Aktívne miesto tohto enzýmu sa skladá z asparagínu-alanínu-mechanín-peasparagín-glycín-glycín-koragín-plain-metonín-metonín-metonín (NAM-nag-NAM).
Proteázový serin
Enzýmy tejto skupiny sú zodpovedné za hydrolyzovacie peptidové väzby v peptidoch a proteínoch. Najbežnejšie študované sú TRPSIN a Chimotripsin; Existuje však veľa rôznych typov proteáz, ktoré sa líšia v závislosti od špecifickosti substrátu a jeho mechanizmu katalýzy.
„Proteázy“ sa vyznačujú vlastnením nukleofilnej aminokyseliny typu serínu. Proteasas Serin je tiež schopný prelomiť širokú škálu esterových odkazov.
Môže vám slúžiť: Aké je chemické zloženie živých bytostí?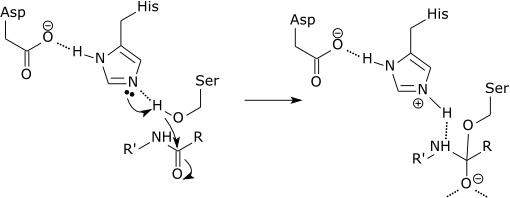 Grafická schéma účinku proteázy, ktorá prelomí peptidové spojenie v aminokyseline histidínu (zdroj: Zephyris v anglickom jazyku Wikipedia [CC BY-SA 3.0 (http: // creativeCommons.Org/licencie/By-SA/3.0/)] Via Wikimedia Commons)
Grafická schéma účinku proteázy, ktorá prelomí peptidové spojenie v aminokyseline histidínu (zdroj: Zephyris v anglickom jazyku Wikipedia [CC BY-SA 3.0 (http: // creativeCommons.Org/licencie/By-SA/3.0/)] Via Wikimedia Commons) Tieto enzýmy rezajú peptidy a proteíny nešpecifickým spôsobom. Avšak všetky peptidy a proteíny, ktoré sa majú rezať.
Každá krátka proteáza je presne väzba Amida, ktorá sa tvorí medzi C-terminálnym koncom aminokyseliny na karboxylovom konci a amínovou amínovou amínom, ktorý je smerom k N-terminálnemu koncu peptidu.
Nukleázové fosfatázy
Tieto enzýmy katalóg. Existuje veľa rôznych typov týchto enzýmov, pretože sú špecifické pre typ nukleovej kyseliny a rezacie miesto.
 Grafická schéma pôsobenia endonukleázy hydrolyzujúca fosfodiérovú väzbu (zdroj: J3D3 [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Via Wikimedia Commons)
Grafická schéma pôsobenia endonukleázy hydrolyzujúca fosfodiérovú väzbu (zdroj: J3D3 [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Via Wikimedia Commons) Endonukleázy sú nevyhnutné v oblasti biotechnológie, pretože umožňujú vedcom modifikovať genómy organizmov rezaním a nahradením fragmentov genetických informácií takmer akejkoľvek bunky.
Endonukleázy robia odrezanie dusíkatých báz v troch krokoch. Prvý je cez nukleofilnú aminokyselinu, potom sa vytvorí sprostredkovateľská štruktúra s negatívnym zaťažením, ktorá priťahuje fosfátovú skupinu a nakoniec prelomí spojenie medzi týmito dvoma základňami.
Odkazy
- Davies, G., & Henrissat, b. (Devätnásť deväťdesiatpäť). Štruktúry a mechanizmy glykozylových hydrolov. Štruktúra, 3 (9), 853-859.
- Lehninger, a. L., Nelson, D. L., Cox, m. M., & Cox, M. M. (2005). Lehninger princípy biochémie. Macmillan.
- Mathews, a. P. (1936). Zásady biochémie. W. Drevo.
- Murray, r. Klimatizovať., Granner, D. Klimatizovať., Mayes, P., & Rodwell, V. (2009). Harperova ilustrovaná biochémia. 28 (P. 588). New York: McGraw-Hill.
- Ollis, D. L., Cheeah, e., Cygler, m., Dijkstra, b., Folow, f., Franken, s. M.,… & Sussman, J. L. (1992). A/p hydrolázový záhyb. Inžiniersky proteín, dizajn a výber, 5 (3), 197-211.

